某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1﹣2滴溴水,振荡后溶液呈黄色.
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)猜想
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含 (填化学式,下同)所致.
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含 所致.
(3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的.
供选用的试剂:a.酚酞试液;b.CCl4; c.无水酒精;d. KSCN溶液.
请你在下表中写出丙同学选用的试剂及实验中观察到的现象.(试剂填序号)
(4)结论
氧化性:Br2>Fe3+.故在足量的稀氯化亚铁溶液中,加入1﹣2滴溴水,溶液呈黄色所发生的离子反应方程式为 .
(5)实验后的思考
①根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先被氧化的离子是 (填离子的化学式).
②在100mL FeBr2溶液中通入2.24L Cl2(标准状况),溶液中有1/2的Br﹣被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量的浓度为 .
【考点】化学实验方案的评价.
【专题】无机实验综合.
【分析】(2)Fe2+的颜色:浅绿色,Fe3+的颜色:棕黄色,溴水的颜色:橙黄色.根据题意在足量的氯化亚铁溶液中加入l﹣2滴溴水,如果不发生氧化还原反应,溶液呈黄色是由溴水引起的,如果发生反应:2 Fe2++Br2═2Fe3++2Br﹣,生成Fe3+,溶液呈黄色是由Fe3+引起的.即可得出甲同学、乙同学的结论;
(3)乙同学的观点认为氧化性:Fe3+<Br2,则会发生反应:2 Fe2++Br2═2 Fe3++2Br﹣,要设计方案进行实验证明乙同学的观点确实正确,考虑两种思路.第一,溶液中不存在Br2,然后选择合适试剂检验不存在Br2.第二,溶液中存在Fe3+,选择合适试剂检验存在Fe3+,即可确定乙同学观点正确;
(4)由氧化性Br2>Fe3+,则氯化亚铁溶液中加入1~2滴溴水发生氧化还原反应生成Fe3+;
(5)①还原性强的离子先被氧化;
②根据电子守恒进行计算.
【解答】解:(2)Fe2+的颜色:浅绿色,Fe3+的颜色:棕黄色,溴水的颜色:橙黄色,
根据题意在足量的氯化亚铁溶液中加入l﹣2滴溴水,若Fe3+氧化性强于Br2,则不发生氧化还原反应,溶液呈黄色是由加入溴水引起的;如果Br2氧化性强于Fe3+,则发生反应:2Fe2++Br2═2 Fe3++2Br﹣,生成了Fe3+,则溶液呈黄色是由Fe3+引起的,
因此①中甲同学认为氧化性:Fe3+>Br2,不发生反应,溶液呈黄色是由溴水引起的,
故答案为:Br2;
②中乙同学认为氧化性:Fe3+<Br2,发生反应生成Fe3+,溶液呈黄色是由Fe3+引起的,
故答案为:Fe3+;
(3)乙同学的观点认为氧化性:Fe3+<Br2,则会发生反应:2 Fe2++Br2═2Fe3++2Br﹣,由于溴水少量,要全部参与反应,生成物中生成了Fe3+,
要证明乙同学的观点确实正确,设计两种方案进行实验:方案一:证明溶液中不存在Br2,根据题意,选择试剂四氯化碳来进行萃取实验,由于四氯化碳呈无色、密度大于水、与水不互溶、易溶解Br2,观察到现象为:出现分层现象,下层为四氯化碳,且呈无色.则证明方案一正确;
方案二:证明溶液中存在Fe3+:根据题意,选择试剂硫氰化钾溶液,观察到现象为溶液呈血红色.则证明方案二正确.方案一、方案二都正确即可证明乙同学的观点确实正确,
故答案为:
| | 试剂 | 实验现象 |
| 方案1 | d | 溶液变成(血)红色 |
| 方案2 | b | 下层的四氯化碳溶液依然无色 |
;
(4)由氧化性Br2>Fe3+,则氯化亚铁溶液中加入1~2滴溴水发生氧化还原反应生成Fe3+,反应为2Fe2++Br2=2Fe3++2Br﹣,
故答案为:2Fe2++Br2=2Fe3++2Br﹣;
(5)①因还原性Fe2+>Br﹣,通入氯气时还原性强的离子先被氧化,即Fe2+先被氧化,
故答案为:Fe2+;
②设FeBr2的物质的量浓度为c,
由电子守恒可知,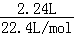 ×2×1=c×0.1L×(3﹣2)+c×0.1L×2×
×2×1=c×0.1L×(3﹣2)+c×0.1L×2× ×(1﹣0),
×(1﹣0),
解得c=1mol/L,
故答案为:1mol/L.
【点评】本题考查了性质实验方案的设计与评价,题目难度中等,明确实验目的为解答关键,学生应注意物质的性质及氧化还原反应中电子守恒来分析,试题培养了学生的分析、理解能力及化学实验能力.
