常温下,用0.1000mol/L NaOH溶液分别滴定20.00mL 0.1000mol/L 盐酸和20.00mL 0.1000mol/L 醋酸溶液,得到2条滴定曲线,如图所示.若以HA表示酸,下列说法正确的是( )
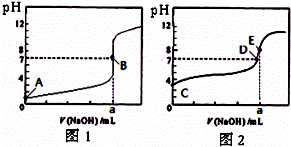
| | A. | 滴定盐酸的曲线是图2 |
| | B. | 达到B、D状态时,两溶液中离子浓度均为 c(Na+)=c(A﹣) |
| | C. | 达到B、E状态时,反应消耗的n(CH3COOH)>n(HCl) |
| | D. | 当0 mL<V(NaOH)<20.00 mL时,对应混合溶液中各离子浓度由大到小的顺序均为 c(A﹣)>c(Na+)>c(H+)>c(OH﹣) |
考点:
酸碱混合时的定性判断及有关ph的计算;弱电解质在水溶液中的电离平衡;离子浓度大小的比较. | | 专题: | 压轴题;电离平衡与溶液的pH专题. |
| 分析: | A、根据盐酸和醋酸在滴定开始时的pH来判断; B、根据溶液中的电荷守恒来判断; C、根据酸和碱反应的化学方程式来计算回答; D、根据氢氧化钠和醋酸以及盐酸反应的原理来回答. |
| 解答: | 解:A、滴定开始时0.1000mol/L盐酸pH=1,0.1000mol/L醋酸pH>1,所以滴定盐酸的曲线是图1,故A错误; B、达到B、D状态时,溶液是中性的,此时c(H+)=c(OH﹣),根据电荷守恒,则两溶液中离子浓度均为 c(Na+)=c(A﹣),故B正确; C、达到B、E状态时,消耗的氢氧化钠物质的量是相等的,根据反应原理:HCl~NaOH,CH3COOH~NaOH,反应消耗的 n(CH3COOH)=n(HCl),故C错误; D、当0 mL<V(NaOH)<20.00 mL时,酸相对于碱来说是过量的,所得溶液是生成的盐和酸的混合物,假设当加入的氢氧化钠极少量时,生成了极少量的钠盐(氯化钠或是醋酸钠),剩余大量的酸,此时c(A﹣)>c(H+)>c(Na+)>c(OH﹣),故D错误. 故选B. |
| 点评: | 本题考查NaOH与CH3COOH、盐酸的反应,涉及盐类的水解和溶液离子浓度的大小比较知识,注意利用电荷守恒的角度做题. |

