室温下,将1.000mol•L﹣1盐酸滴入20.00mL 1.000mol•L﹣1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )
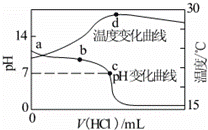
|
| A. | a点由水电离出的c(H+)=1.0×10﹣14mol•L﹣1 |
|
| B. | b点:c(NH4+)+c(NH3•H2O)=c(Cl﹣) |
|
| C. | c点:c(Cl﹣)=c(NH4+) |
|
| D. | d点后,溶液温度略下降的主要原因是NH3•H2O电离吸热 |
室温下,将1.000mol•L﹣1盐酸滴入20.00mL 1.000mol•L﹣1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )

|
| A. | a点由水电离出的c(H+)=1.0×10﹣14mol•L﹣1 |
|
| B. | b点:c(NH4+)+c(NH3•H2O)=c(Cl﹣) |
|
| C. | c点:c(Cl﹣)=c(NH4+) |
|
| D. | d点后,溶液温度略下降的主要原因是NH3•H2O电离吸热 |
考点:
酸碱混合时的定性判断及有关ph的计算.
专题:
压轴题.
分析:
根据酸碱滴定过程的图中a、b、c点的pH值来分析溶液中离子的浓度或溶液中的溶质,并利用原子守恒和电荷守恒来分析解答.
解答:
解:A、因a点7<pH<14,因此水电离出的c(H+)>1.0×10﹣14mol•L﹣1,故A错误;
B、b点时pH>7,则盐酸和氨水反应,氨水过量,则c(NH4+)+c(NH3•H2O)>c(Cl﹣),故B错误;
C、因c点pH=7溶液呈中性,则c(H+)=c(OH﹣),根据电荷守恒可知c(Cl﹣)=c(NH4+),故C正确;
D、d点时盐酸和氨水恰好完全反应,放热最多,再加盐酸温度降低只能是加入盐酸的温度低于溶液温度,这才是温度下降的原因,故D错误;
故选:C.
点评:
本题考查水溶液中的电离平衡以及酸碱中和滴定,明确滴定曲线中各点的pH是解答的关键,并学会利用物料守恒、电荷守恒来解答此类习题.