锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成
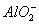
。
完成下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为____________(用化学式表示)。
(2)写出锌和氢氧化钠溶液反应的化学方程式______________________________________。
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是____________________。
①硫酸铝和氢氧化钠 ②硫酸铝和氨水
③硫酸锌和氢氧化钠 ④硫酸锌和氨水
(4)写出可溶性铝盐和氨水反应的离子方程式____________________________________。
试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因__________________。
解析:本题考查两性氢氧化物的有关知识。氢氧化铝是学生熟悉的两性氢氧化物,根据知识迁移,不难理解氢氧化锌的两性。
(1)2Al+2NaOH+2H2O====2NaAlO2+H2↑,单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为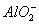 。
。
(2)锌和氢氧化钠溶液反应的化学方程式为:Zn+2NaOH====Na2ZnO2+H2↑或Zn+2NaOH+2H2O====Na2Zn(OH)4+H2↑
(3)硫酸铝滴入氢氧化钠溶液中,现象是先无沉淀生成,过量后产生氢氧化铝白色沉淀,氢氧化钠滴入硫酸铝溶液中,现象是先产生氢氧化铝白色沉淀,过量后沉淀溶解;硫酸锌滴入氢氧化钠溶液中,现象是先无沉淀生成,过量后产生氢氧化锌白色沉淀,氢氧化钠滴入硫酸锌溶液中,现象是先产生氢氧化锌白色沉淀,过量后沉淀溶解;硫酸锌滴入氨水中,无沉淀生成,氨水滴入硫酸锌溶液中先产生氢氧化锌白色沉淀,过量后沉淀溶解,所以选①③④。
(4)注意Al(OH)3不溶于氨水,Zn(OH)2溶于氨水。
答案:(1)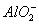 〔或
〔或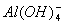 〕
〕
(2)Zn+2NaOH====Na2ZnO2+H2↑ 〔或Zn+2NaOH+2H2O====Na2Zn(OH)4+H2↑〕
(3)①③④ (4)Al3++3NH3·H2O====Al(OH)3↓+3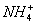
可溶性锌盐与氨水反应产生的Zn(OH)2可溶于过量氨水中,生成 ,氨水用量不易控制
,氨水用量不易控制
