有7种物质:NH
3、Mn
2O
3、ZnCl
2、MnO
2、NH
4Cl、Zn和H
2O,分别是锌—锰电池中氧化还原反应的反应物和生成物。
(1)①完成并配平该氧化还原方程式:
_____________+_____________+_____________NH4Cl _____________+_____________+_____________+_____________NH3
_____________+_____________+_____________+_____________NH3
②发生还原反应的物质是_____________,被氧化的元素是_____________。
③若有17.4 g氧化剂参与反应,则电子转移数目为_____________NA(NA表示阿伏加德罗常数)。
(2)普通锌—锰干电池是利用上述反应原理设计的,其结构如下图所示。回答下列问题:

①电池中电解质溶液为_______________________________________。
②正极材料为____________________________________________________;
正极电极反应为____________________________________________________。
③放电时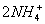
向_______________(填“正极”或“负极”)移动。
④普通锌—锰电池的缺点是电量小、放电电流弱。为增大放电电流,可把负极锌片改为锌粉,其理由是____________________________________________________。
解析:(1)由题意知:反应混合物中Mn2O3、ZnCl2、MnO2、Zn四种成分必定为氧化剂、还原剂、氧化产物、还原产物,考虑到反应的自发性,Zn必定为还原剂,是被氧化的元素,MnO2必定为氧化剂,是发生还原反应的物质,ZnCl2为氧化产物,Mn2O3为还原产物,由化合价升降相等,及原子守恒即可配平方程式。若有17.4 g氧化剂参与反应,即0.2 mol MnO2参与反应,故电子转移数目为0.2NA。
(2)反应混合物中除Mn2O3、ZnCl2、MnO2、Zn四种成分之外,还有NH3、NH4Cl和H2O,其中NH4Cl是反应物,故电解质溶液为NH4Cl溶液;正极材料为石墨,正极电极反应为2MnO2+2e-+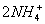

Mn
2O
3+H
2O+2NH
3;放电时,阳离子
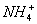
向正极移动。把负极锌片改为锌粉,增大了反应接触面积,提高了电池的工作效率。
答案:(1)①Zn 2MnO2 2 ZnCl2 Mn2O3 H2O 2 ②MnO2 Zn ③0.2
(2)①NH4Cl(或氯化铵)
②石墨2MnO2+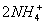
+2e
-
Mn
2O
3+2NH
3+H
2O
③正极
④使反应面积成倍增大,提高放电效率
![]() _____________+_____________+_____________+_____________NH3
_____________+_____________+_____________+_____________NH3
![]()
