电解法促进橄榄石(主要成分是Mg2SiO4)固定CO2的部分工艺流程如下:
已知:Mg2SiO4(s) +4HCl(aq) 2MgCl2(aq) +SiO2 (s) + 2H2O(l) △H=-49.04 kJ·mol-1
2MgCl2(aq) +SiO2 (s) + 2H2O(l) △H=-49.04 kJ·mol-1
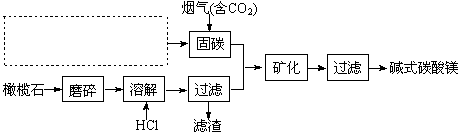
(1)某橄榄石的组成是Mg9FeSi5O20,用氧化物的形式可表示为。
(2)固碳时主要反应的方程式为NaOH(aq)+CO2 (g)=NaHCO3 (aq),该反应能自发进行的原因是。
(3)请在上图虚框内补充一步工业生产流程
。
(4)下列物质中也可用作“固碳”的是。(填字母)
a.CaCl2 b.H2NCH2COONa c.(NH4)2CO3
(5)由图可知,90℃后曲线A溶解效率下降,分析其原因。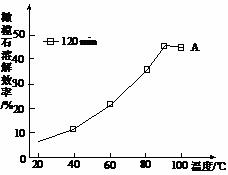
(6)经分析,所得碱式碳酸镁产品中含有少量NaCl和Fe2O3。为提纯,可采取的措施依次为:对溶解后所得溶液进行除铁处理、对产品进行洗涤处理。判断产品洗净的操作是。
【答案解析】(1)9MgO·FeO·5SiO2(2)ΔH<0
(3)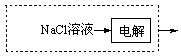 或
或
(4)bc
(5)120min后,溶解达到平衡,而反应放热,升温平衡逆向移动,溶解效率降低。
(6)取少量最后一次的洗涤液,加硝酸酸化的硝酸银溶液,如无沉淀产生,则已洗净。
解析:(1)硅酸盐中含金属元素、Si、O,有的还有结晶水,一般是先写金属氧化物,再写非金属氧化物,最后写H2O;多种金属元素,则按金属活动顺序表,活泼金属氧化物在前,不活泼金属氧化物在后,因此橄榄石用氧化物的形式可表示为9MgO·FeO·5SiO2 。
(2)NaOH(aq)+CO2(g)=NaHCO3(aq),该反应是混乱度减小的,不利用自发,根据反应的自发性的复合判据知要自发只能是正反应是放热反应,即ΔH<0 。
(3)根据NaOH(aq)+CO2 (g)=NaHCO3 (aq)可以看出需要用到氢氧化钠溶液固碳,所以图虚框内补充得到氢氧化钠一步工业生产流程即可,可能通过电解饱和的氯化钠溶液,可以写为
或
(4)CaCl2溶液不会与二氧化碳反应;H2NCH2COONa,是氨基酸,氨基能与酸反应生成盐,能固碳,(NH4)2CO3溶液能与二氧化碳反应,生成碳酸氢铵,故选bc。
(5)由图可知,120min后,溶解达到平衡,而溶解反应是放热反应,升温平衡逆向移动,溶解效率降低。
(6)根据流程知新产品若没有洗净,可能有Cl-,而Cl-可通过加硝酸银检验,方法是取少量最后一次的洗涤液,加硝酸酸化的硝酸银溶液,如无沉淀产生,则已洗净。
![]() 2MgCl2(aq) +SiO2 (s) + 2H2O(l) △H=-49.04 kJ·mol-1
2MgCl2(aq) +SiO2 (s) + 2H2O(l) △H=-49.04 kJ·mol-1



