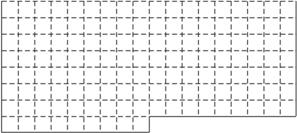
(1)上表中的实线是元素周期表部分边界,请在表中用实线补全主族元素边界。
(2)元素甲是第三周期ⅦA族元素,化合物A是由甲元素等三种非金属元素组成的离子化合物。请写出化合物A的化学式_________,并指出化合物A中的化学键类型:________。
(3)元素乙是第三周期金属元素中原子半径最小的元素,写出工业上制金属乙的化学方程式_______________________________________。
(4)化合物B是由甲元素和乙元素形成的化合物,将等物质的量的化合物A和化合物B溶于水中,向其中逐滴加入过量的2 mol·L-1 NaOH溶液,直至形成透明溶液。请根据实验操作过程依次写出反应的离子方程式__________________________________________________。
(5)25 ℃下,等物质的量浓度的化合物A与化合物B溶液中水的电离程度的关系A________B(填“>”“<”或“=”)
(1)略
(2)NH4Cl 离子键、共价键
(3)2Al2O3 4Al+3O2↑
4Al+3O2↑
(4)Al3++3OH-====Al(OH)3↓
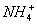 +OH-
+OH-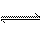 NH3·H2O
NH3·H2O
Al(OH)3+OH-====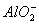 +2H2O
+2H2O
(5)<
解析:(2)问,位于第三周期ⅦA族的甲元素为Cl元素,而仅由非金属组成的离子化合物只能是铵盐,则A必为NH4Cl,其含有的化学键类型为共价键和离子键(还有配位键)。(3)问,第三周期金属元素中原子半径最小的元素乙是Al元素,工业制法的化学方程式为2Al2O3 4Al+3O2↑。(4)问,甲元素(Cl)和乙元素(Al)形成的化合物B是AlCl3,其与化合物A(NH4Cl)溶于水后滴加NaOH溶液,依次发生反应的离子方程式为Al3++3OH-====Al(OH)3↓,
4Al+3O2↑。(4)问,甲元素(Cl)和乙元素(Al)形成的化合物B是AlCl3,其与化合物A(NH4Cl)溶于水后滴加NaOH溶液,依次发生反应的离子方程式为Al3++3OH-====Al(OH)3↓,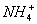 +OH-====NH3·H2O,Al(OH)3+OH-====
+OH-====NH3·H2O,Al(OH)3+OH-====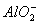 +2H2O。(5)问,同属于弱盐的A(NH4Cl)和B(AlCl3)都促进水的电离,因
+2H2O。(5)问,同属于弱盐的A(NH4Cl)和B(AlCl3)都促进水的电离,因 水解程度比Al3+水解程度小而对水电离的促进作用更弱,则A(NH4Cl)溶液中水的电离程度较B(AlCl3)溶液中小。
水解程度比Al3+水解程度小而对水电离的促进作用更弱,则A(NH4Cl)溶液中水的电离程度较B(AlCl3)溶液中小。

