实验室可用冰醋酸(CH
3COOH)和异戊醇(
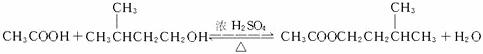
)合成乙酸异戊酯,其实验装置如图所示,操作过程如下:

①向圆底烧瓶中加入几粒碎瓷片,先后注入15 mL(0.14 mol)异戊醇和20 mL(0.35 mol)冰醋酸,最后小心加入5 mL浓H2SO4,振荡使其不再分层。
②在烧瓶上安装水冷凝管,连好上、下水,后加热装置1 h冷却至室温。
③把烧瓶内混合液倒入盛有饱和Na2CO3溶液的锥形瓶中,振荡后静置。
④把③中水层分离出后,再用蒸馏水洗涤有机层几次,并将洗涤后水层分离出。
⑤将分离的有机层转移到另一锥形瓶中,加入无水MgSO4或Mg(NO3)2处理。最后将处理后的有机层经135—143 ℃蒸馏,即得乙酸异戊酯产品。
试完成以下问题:
(1)写出乙酸和异戊醇合成乙酸异戊酯的化学方程式________________________________,其中浓H2SO4的作用是____________________________________,烧瓶内碎瓷片的作用是_______________________________。
(2)水冷凝器的作用是_____________,冷凝管的a口是冷却水的_____________(填“进口”“出口”)。
(3)乙酸和异戊醇物质的量之比0.35∶0.14大于1∶1,其原因是_____________。
(4)③中饱和碳酸钠的作用是_____________;⑤中无水MgSO4或Mg(NO3)2的作用是_____________。
(5)步骤③的操作应用_____________(填仪器名称),洗涤分离出水层后,应怎样把有机层转移至锥形瓶里_____________。
解析:此题是有关有机物制备的实验题。题中完整地给出乙酸异戊酯的合成过程,且设问中的5个小题都是围绕着实验原理和操作方法提出的。表面上考查的是合成乙酸异戊酯的实验内容,但实质上还是考查中学制备乙酸乙酯的实验,当然,试题中的装置和操作又与中学的乙酸乙酯实验有所不同,即增加了对冷凝管、分液漏斗的使用的考查。这将有助于提高学生的信息迁移能力,同时提高他们分析和解决问题的能力。
(1)酯化反应的实质是羧酸脱羟基、醇脱氢结合成水的取代反应,其中浓硫酸在反应中起催化剂和脱水剂的作用,为了防止在加热过程中液体暴沸,预先在烧瓶中加入碎瓷片。
(2)酯化反应的进行是需要加热的,但其反应物冰醋酸和异戊醇及其生成物乙酸异戊酯都属于低沸点物质,故在反应过程中极易形成蒸气逸出,为了使反应物充分利用,常用冷凝管使蒸气冷凝回流。使用冷凝管时要注意水流方向,即水流方向应与被冷却气体的流向相反,即图中的a口应是出水方向。
(3)从乙酸与异戊醇的反应方程式:

可以看出,乙酸与异戊醇是按1∶1的方式消耗的,但由于该反应是可逆反应,为了提高成本较高的异戊醇的转化率,常使廉价的乙酸过量。
(4)反应完毕后,烧瓶中的混合液中含有H2SO4、乙酸、异戊醇、乙酸异戊酯、水等物质,倒入饱和Na2CO3溶液中后,混合液中的H2SO4和过量的乙酸将与Na2CO3反应而最后位于水层,有机层主要是乙酸异戊酯和异戊醇,另有少量的水,蒸馏可使乙酸异戊酯和异戊醇分离,蒸馏时加入MgSO4或Mg(NO3)2可吸收有机层中的水分〔可联想工业制浓HNO3时加Mg(NO3)2吸水〕。
(5)③中所得分层后的混合物,用分液漏斗进行分离,使用分液漏斗分液时要注意:下层液体从分液漏斗的下端流出,上层液体应从分液漏斗的上口处倒出。

催化剂和脱水剂 防止液体暴沸
(2)冷凝回流 出口
(3)因该反应是可逆反应,增大廉价的乙酸的量,可以提高异戊醇的转化率
(4)洗涤乙酸异戊酯中的H2SO4和过量的CH3COOH 吸收乙酸异戊酯中残留的水
(5)分液漏斗 应将有机层从分液漏斗的上口处倒出


