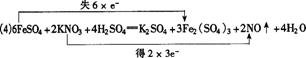在热的稀硫酸溶液中溶解了11.4g硫酸亚铁固体,当加入50mL 0.5mol/L KNO3溶液后,使其中的Fe2+全部转化成Fe3+,KNO3也完全反应并放出NxOy气体。
(1)推算出 x =_____;y =______。
(2)配平该反应的方程式:
__ FeSO4+ __ KNO3 +___H2SO4 — ____K2SO4 + ___Fe2(SO4)3 +____NxOy + ___H2O
(3)反应中氧化产物是_______________。
(4)用双线桥法表示该反应中的电子转移方向和数目??????:
_____________________________________________。
(1) 1 ; 1
(2)6 FeSO4+ 2 KNO3 +4H2SO4 = K2SO4 + 3Fe2(SO4)3 +2NxOy + 4H2O
(3)Fe2(SO4)3
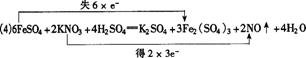
解析:
本题由得失电子守恒法求x和y。配平时先配后观察两步走。判断氧化剂或还原剂的方法是确定反应物和生成物在反应前后化合价的变化,化合价降低的反应物是氧化剂、化合价升高的反应物是还原剂。(1)n(FeSO4)=11.4g/152g·mol-1=0.075mol,KNO3的物质的量为0.05L×0.5mol·L-1=0.025mol,设NO3-与NxOy中N元素化合价差为a,根据得失电子总数相等的原则,可得关系式:0.075×1=0.025×a ,所以a=3即NxOy中N元素化合价为+2价,NxOy为NO ,所以x=y=1 (2)先配平氧化剂、还原剂、还原产物、氧化产物的化学计量数,再配平其他物质的化学计量数:6FeSO4+2KNO3+4H2SO4=3Fe2(SO4)3+K2SO4+2NO↑+4H2O (3)FeSO4中Fe元素失去电子,KNO3??中N元素得到电子,电子从铁元素向氮元素转移。电子总数为6e-,所以电子转移方向为FeSO4中Fe2+失e-,KNO3中氮得e-,故KNO3为氧化剂。还原剂为FeSO4,氧化产物是Fe2(SO4)3