A~H均为短周期元素,A~F在元素周期表中的相对位置如图所示,G与其它七种元素不在同一周期,H是短周期中原子半径最大的主族元素。由B、G组成的气态化合物甲水溶液呈碱性。
请回答下列问题:
(1)写出甲的电子式 ,实验室制取气体甲的化学方程式为 。
(2)B、C、G个数比为1:1:5形成的化合物的化学键类型为 。
A.离子键 B. 极性键 C. 非极性键
(3)请用电子式表示AE2的形成过程 。
(4)用离子符号表示C、E、F、H四种离子的半径由大到小的顺序 。
(5)用一个离子方程式解释A比D非金属性强的原因 。
【答案】(1)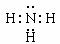 (1分) 2NH4Cl+Ca(OH)2
(1分) 2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O (2分)
CaCl2+2NH3↑+2H2O (2分)
(2)b (2分) (3)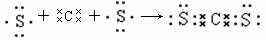 (2分)
(2分)
(4)S2->Cl->O2->Na+(2分) (5)CO2+H2O+SiO32-=CO32-+H2SiO3 ↓(2分)(其它合理的也得分)
【解析】
试题分析:A~H均为短周期元素,A~F在元素周期表中的相对位置如图所示,G与其它七种元素不在同一周期,则G是氢元素。H是短周期中原子半径最大的主族元素,所以H是钠元素。由B、G组成的气态化合物甲水溶液呈碱性,该化合物是氨气,则B是N元素,所以A是碳元素,D是硅元素,C是氧元素,E是硫元素,F是氯元素。
(1)甲是氨气,属于共价化合物,氨气的电子式为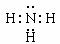 。实验室制取气体氨气利用的是氢氧化钙和氯化铵加热制备,反应的化学方程式为
。实验室制取气体氨气利用的是氢氧化钙和氯化铵加热制备,反应的化学方程式为
2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O。
CaCl2+2NH3↑+2H2O。
(2)B、C、G个数比为1:1:5形成的化合物是一水合氨,其中的化学键类型为极性键,答案选b。
(3)CS2是含有极性键的共价化合物,其形成过程可表示为
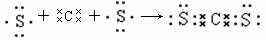 。
。
(4)离子的核外电子层数越多,离子半径越大,核外电子排布相同的离子,其离子半径随原子序数的增大而减小,则C、E、F、H四种离子的半径由大到小的顺序)S2->Cl->O2->Na+。
(5)非金属性越强,则最高价氧化物水化物的酸性越强。根据较强酸制备较弱酸可知A比D非金属性强的原因可以用方程式CO2+H2O+SiO32-=CO32-+H2SiO3 ↓表示。
【考点定位】本题主要是考查元素推断及元素周期律的应用等
【名师点晴】电子式是表示微粒结构的一种式子,其写法是在元素符号的周围用“·”或“×”等表示原子或离子的最外层电子,并用n+或n-(n为正整数)表示离子所带电荷。书写化合物的电子式时,应注意原子间的连接顺序,确定原子间连接顺序的方法是先标出各原子的化合价,然后根据异性微粒相邻,同性微粒相间的原则确定,如HClO中各元素的化合价为分别是+1、+1和-2价,其结构式为H—O—Cl,电子式为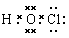 。
。
