I、卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物.
(1)①HClO4、②HIO4、③H5IO6 的酸性由强到弱的顺序为 (填序号).
(2)卤素互化物如BrI、ICl等与卤素单质结构相似、性质相近.Cl2、BrI、ICl沸点由高到低的顺序为 .
(3)气态氟化氢中存在二聚分子(HF)2,这是由于 .
(4)I3+(可看成II2+)属于多卤素阳离子,根据VSEPR模型推测I3+的空间构型为 .
(5)卤化物RbICl2加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,A的化学式为 .
II.氮可以形成多种离子,如N3﹣,NH2﹣,N3﹣,NH4+,N2H5+,N2H62+等,已知N2H5+与N2H62+是由中性分子结合质子形成的,类似于NH4+,因此有类似于 NH4+的性质.
(1)出N2H62+在足量碱性溶液中反应的离子方程式 .
(2)NH2﹣的电子式为 .
(3)写出两种由多个原子组成的含有与N3﹣电子数相同的物质的化学式 .
(4)等电子数的微粒往往具有相似的结构,试预测N3﹣的构型 .
(5)据报道,美国科学家1998年11月合成了一种名为“N5”的物质,由于其具有极强的爆炸性,又称为“盐粒炸弹”.迄今为止,人们对它的结构尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形.如果5个N结合后都达到8电子结构,且含有2个N≡N键.则“N5”分子碎片 所带电荷是 .
考点:
氯、溴、碘及其化合物的综合应用;判断简单分子或离子的构型. | | 专题: | 信息给予题;卤族元素. |
| 分析: | I、(1)非金属性越强,则对应最高价含氧酸的酸性就强,同种元素的含氧酸通式为(HO)mROn,n值越大酸性越强. (2)都是分子晶体,结构相似,相对分子质量越大沸点越高. (3)F的电负性很强,HF分子间存在氢键. (4)中心I原子的价层电子对数为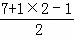 =4,价层电子对为正四面体,中心I原子的孤电子对数为 =4,价层电子对为正四面体,中心I原子的孤电子对数为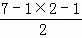 =2,据此判断. =2,据此判断. (5)晶格能越大,离子键越强,利用半径来分析晶格能相对较大的卤化物. II.(1)N2H62+是由中性分子结合质子形成的,该中性分子为N2H4,类似于NH4+,因此有类似于 NH4+的性质,故N2H62+在足量碱性溶液中反应生成N2H4与水. (2)NH2﹣可以看做NH3失去1个H+,N原子越H原子之间形成1对共用电子对,N原子有2对孤对电子对. (3)可将N3﹣中“N﹣”换为O得到N2O,还可进行类似变换得到其他等电子体. (4)CO2与N3﹣的是等电子体,等电子体相似的结构. (5)依题干信息,将分子中原子排成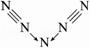 ,两边的两个氮原子通过形成三对共用电子达到8电子结构,则中间N原子得两边的各一个N原子提供一对电子再失去一个电子,这样此N原子最外层也达8电子结构. ,两边的两个氮原子通过形成三对共用电子达到8电子结构,则中间N原子得两边的各一个N原子提供一对电子再失去一个电子,这样此N原子最外层也达8电子结构. |
| 解答: | 解:(1)因非金属性Cl>Br>I,非金属性越强,则对应的最高价氧化物的酸性越强,则①的酸性最强,在②③中都是碘元素的含氧酸,分别可以写成(HO)1IO3、(HO)5IO1,非羟基氧个数越多,酸性越强,则酸性到为②>③. 故答案为:①②③. (2)因相对分子质量BrI>ICl>Cl2 ,则范德华力BrI>ICl>Cl2 ,即沸点BrI>ICl>Cl2 . 故答案为:BrI>ICl>Cl2. (3)因F的电负性最大,则HF分子中存在氢键形成二聚分子. 故答案为:HF分子间形成氢键. (4)因I3+可看成II2+,中心I原子的价层电子对数为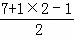 =4,价层电子对为正四面体,中心I原子的孤电子对数为 =4,价层电子对为正四面体,中心I原子的孤电子对数为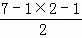 =2,则I3+的空间构型为V形. =2,则I3+的空间构型为V形. 故答案为:V形. (5)RbICl2加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,氯离子的半径小于碘离子的半径,则RbCl的离子键长小于RbI的离子键长,则RbCl的晶格能较大,则A为RbCl. 故答案为:RbCl. II.(1)N2H62+是由中性分子结合质子形成的,该中性分子为N2H4,类似于NH4+,因此有类似于 NH4+的性质,故N2H62+在足量碱性溶液中反应生成N2H4与水,反应方程式为N2H62++2OH﹣=N2H4+2H2O. 故答案为:N2H62++2OH﹣=N2H4+2H2O. (2)NH2﹣可以看做NH3失去1个H+,N原子越H原子之间形成1对共用电子对,N原子有2对孤对电子对,NH2﹣电子式为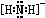 . . 故答案为: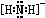 . . (3)可将N3﹣中“N﹣”换为O得到N2O,1个C原子和1个O原子相当于2个N原子,可得CO2,还可进行类似变换得到其他等电子数微粒,如CNO﹣、BeF2、C3H4. 故答案为:N2O、CO2. (4)CO2与N3﹣的是等电子体,等电子体相似的结构,CO2是直线型,故N3﹣可能是直线型. 故答案为:直线型. (5)依题干信息,将分子中原子排成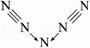 ,两边的两个氮原子通过形成三对共用电子达到8电子结构,则中间N原子得两边的各一个N原子提供一对电子再失去一个电子,这样此N原子最外层也达8电子结构,“N5”分子碎片所带电荷是一个单位正电荷. ,两边的两个氮原子通过形成三对共用电子达到8电子结构,则中间N原子得两边的各一个N原子提供一对电子再失去一个电子,这样此N原子最外层也达8电子结构,“N5”分子碎片所带电荷是一个单位正电荷. 故答案为:一个单位正电荷. |
| 点评: | 本题综合性较大,以信息形成考查学生阅读提取信息能力、分子结构与性质、常用化学用语等,需要学生具备扎实的知识和运用信息、基础知识分析问题解决问题的能力,难度较大. |
