A、B、C、D、E、F六种短周期元索,它们的原子序数依次增大,A与D同主
A、B、C、D、E、F六种短周期元索,它们的原子序数依次增大,A与D同主族;C与E同主族;B、C同周期;B原子最外层电子数比其次外层电子数多2;A是周期表中半径最小的元素,C的最外层电子数是内层电子的3倍;F元素是同周期元素中原子半径最小的主族元素。A、B、C、D、E形成的化合物甲、乙、丙、丁的组成如表所示:
| 化合物 | 甲 | 乙 | 丙 | 丁 |
| 化学式 | A2C | A2C2 | D2C2 | D2E |
回答下列问题:
(1)指出元素F在周期表中的位置___________。
(2)化合物丙的电子式为__________,用电子式表示形成化合物丁的过程_______。
(3) 向丁的溶液中加入硫酸酸化的乙溶液,写出相应的离子方程式:_______。
(4)固体氧化物燃料电池是以固体氧化锆一氧化钇为电解质,这种固体电解质在高温下允许02-在其间通过,该电池的工作原理如图所示,其中多孔Pt电极a、b分别是气体C2、A2的载体。该电池的正极为______ (填a或b);02-流向______极(填“正”或“负”);该电池的负极反应为 _________ 。

【答案】 (1). 第三周期第ⅦA族 (2). 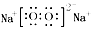 (3).
(3). 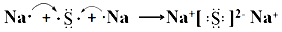 (4). S2-+2H++H2O2=S↓+2 H2O (5). a (6). 负 (7). H2 —2e-+O2-=H2O
(4). S2-+2H++H2O2=S↓+2 H2O (5). a (6). 负 (7). H2 —2e-+O2-=H2O
【解析】原子序数依次增大的A、B、C、D、E、F六种短周期元素,B原子最外层电子数比其次外层电子数多2,原子只能有2个电子层,最外层电子数为4,则B为碳元素;A是周期表中半径最小的元素,则A为H元素;C的最外层电子数是内层电子的3倍,原子只能有2个电子层,最外层电子数为6,故C为O元素;C与E同主族,则E为S元素;A与D同主族,D的原子序数大于氧,故D为Na;F的原子序数最大,且F元素是同周期元素中原子半径最小的主族元素,故F为Cl.可推知甲为H2O、乙为H2O2、丙为Na2O2、丁为Na2S,(1)元素F为Cl,在周期表中的位置:第三周期第ⅦA族;(2)丙为Na2O2,电子式为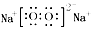 ,用电子式表示形成化合物Na2S的过程:
,用电子式表示形成化合物Na2S的过程: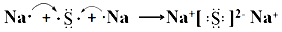 ;(3)丁与乙反应的离子方程式为:S2-+2H++H2O2=S↓+2 H2O ;(4)固体氧化物燃料电池是以固体氧化锆﹣氧化钇为电解质,这种固体电解质在高温下允许O2﹣在其间通过,该电池的工作原理如图所示,其中多孔Pt电极a、b分别是气体O2、H2的载体,负极发生氧化反应,氢气在负极失去电子,该电池的正极为a,O2﹣流向负极,负极发生氧化反应,氢气在负极失去电子与O2﹣生成水,该电池的负极反应式为:H2 —2e-+O2-=H2O。
;(3)丁与乙反应的离子方程式为:S2-+2H++H2O2=S↓+2 H2O ;(4)固体氧化物燃料电池是以固体氧化锆﹣氧化钇为电解质,这种固体电解质在高温下允许O2﹣在其间通过,该电池的工作原理如图所示,其中多孔Pt电极a、b分别是气体O2、H2的载体,负极发生氧化反应,氢气在负极失去电子,该电池的正极为a,O2﹣流向负极,负极发生氧化反应,氢气在负极失去电子与O2﹣生成水,该电池的负极反应式为:H2 —2e-+O2-=H2O。
点睛:本题考查元素化合物推断、电子式、原电池等,侧重对化学用语的考查,推断元素是解题关键,注意基础知识的全面掌握,难度中等。

