游离态的氮经一系列转化可以得到硝酸,如下图所示。 (1)NH3和O2在
游离态的氮经一系列转化可以得到硝酸,如下图所示。

(1)NH3和O2在催化剂作用下反应,其化学方程式是______________。学科...
(2)NO2→HNO3反应中氧化剂和还原剂的物质的量之比为________________。
(3)2NO(g)+O2(g)  2NO2(g)是制造硝酸的重要反应之一。在800℃时,向容积为1L的密闭容器中充入0.010molNO和0.005molO2,反应过程中NO的浓度随时间变化如下图所示。
2NO2(g)是制造硝酸的重要反应之一。在800℃时,向容积为1L的密闭容器中充入0.010molNO和0.005molO2,反应过程中NO的浓度随时间变化如下图所示。
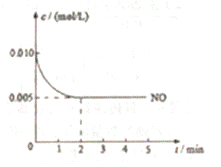
①2min内,v(O2)=________mol/(L·min)
②800℃时,该反应的化学平衡常数为__________。
③判断该反应达到平衡的依据是(写出2条即可)____________。
④已知:ⅰ. 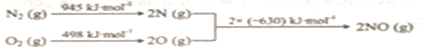
ⅱ.N2(g)+2O2(g)=2NO2(g) ΔH=+68kJ·mol-1,写出NO生成NO2热化学方程式_____________,温度对于NO生成NO2平衡转化率的影响是:___________________。
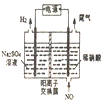
(4)电解法处理含氮氧化物废气,可以回收硝酸。实验室模拟电解法吸收NO,装置如图所示(均为石墨电极)。请写出电极过程中NO转化为硝酸的电极反应式:______________。
【答案】 (1). 4NH3 + 5O2 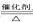 4NO + 6H2O (2). 1:2 (3). 1.25×10-3 (4). 400 (5). 体系压强不变、各物质浓度不变、各物质体积分数不变等等。 (6). 2NO(g)+O2(g)
4NO + 6H2O (2). 1:2 (3). 1.25×10-3 (4). 400 (5). 体系压强不变、各物质浓度不变、各物质体积分数不变等等。 (6). 2NO(g)+O2(g)  2NO2(g) ΔH = -115 kJ·mol-1。 (7). 温度升高,平衡向逆反应方向移动,NO转化为NO2的平衡转化率降低 (8). NO-3e- + 2H2O === NO3- + 4H+
2NO2(g) ΔH = -115 kJ·mol-1。 (7). 温度升高,平衡向逆反应方向移动,NO转化为NO2的平衡转化率降低 (8). NO-3e- + 2H2O === NO3- + 4H+
【解析】(1)NH3和O2在催化剂作用下反应生成一氧化氮和水,反应的化学方程式为4NH3 + 5O2  4NO + 6H2O;(2)NO2溶于水生成硝酸和NO:3NO2+H2O=2HNO3+NO,其中NO是还原产物,硝酸是氧化产物,则反应中氧化剂和还原剂的物质的量之比为1:2;(3)①由图象可知用NO浓度的变化计算反应速率 v(NO)=(0.010mol/L−0.005mol/L)/2min=0.025mol/(L•min),则v(O2)=1/2v(NO)=1.25×10-3mol/(L•min);②
4NO + 6H2O;(2)NO2溶于水生成硝酸和NO:3NO2+H2O=2HNO3+NO,其中NO是还原产物,硝酸是氧化产物,则反应中氧化剂和还原剂的物质的量之比为1:2;(3)①由图象可知用NO浓度的变化计算反应速率 v(NO)=(0.010mol/L−0.005mol/L)/2min=0.025mol/(L•min),则v(O2)=1/2v(NO)=1.25×10-3mol/(L•min);②
2NO(g)+O2(g)⇌2NO2(g)
起始浓度(mol/L) 0.01 0.005 0
平衡浓度(mol/L) 0.005 0.0025 0.005
则k=c2(NO2)/c2(NO)·c(O2)=0.0052/0.0052×0.0025=400;
③在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。该反应是体积减小的可逆反应,所以判断该反应达到平衡的依据有:体系压强不变、各物质浓度不变、各物质体积分数不变等。④i.N2(g)+O2(g)=2NO(g)△H=(945kJ/mol+498kJ/mol)-2×630kJ/mol=+183kJ/mol,ii.N2(g)+2O2(g)=2NO2(g)△H=+68kJ/mol,则盖斯定律ii-i得到2NO(g)+O2(g)=2NO2(g)△H=-115 kJ/mol。温度升高,平衡向逆反应方向移动,NO转化为NO2的平衡转化率降低;(4)电解过程中NO在阳极失去电子转化为硝酸的电极反应式为NO-3e- +2H2O=NO3- + 4H+。

![]() 2NO2(g)是制造硝酸的重要反应之一。在800℃时,向容积为1L的密闭容器中充入0.010molNO和0.005molO2,反应过程中NO的浓度随时间变化如下图所示。
2NO2(g)是制造硝酸的重要反应之一。在800℃时,向容积为1L的密闭容器中充入0.010molNO和0.005molO2,反应过程中NO的浓度随时间变化如下图所示。


