下面是工厂苛化法生产烧碱的示意图.请回答下列问题: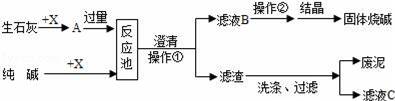

(1)X的化学式为
(2)生石灰可以由 (填名称)高温煅烧而得,其反应的化学方程式为:
(3)操作②的名称是 ;结晶得到的固体烧碱中可能含有少量的 (写化学式);烧碱有强烈的腐蚀性,如果不慎将碱液沾到皮肤上,可用较多的水冲洗,再涂上稀 溶液.
(4)滤液C可加入反应池循环再利用,目的是降低生产成本和防止 .
下面是工厂苛化法生产烧碱的示意图.请回答下列问题:

(1)X的化学式为
(2)生石灰可以由 (填名称)高温煅烧而得,其反应的化学方程式为:
(3)操作②的名称是 ;结晶得到的固体烧碱中可能含有少量的 (写化学式);烧碱有强烈的腐蚀性,如果不慎将碱液沾到皮肤上,可用较多的水冲洗,再涂上稀 溶液.
(4)滤液C可加入反应池循环再利用,目的是降低生产成本和防止 .
【考点】物质的相互转化和制备;混合物的分离方法;生石灰的性质与用途;碳酸钠、碳酸氢钠与碳酸钙;书写化学方程式、文字表达式、电离方程式.
【专题】压轴实验题;物质的制备.
【分析】由图示的过程可知利用氧化钙和纯碱制取氢氧化钙的过程是:氧化钙与水反应生成氢氧化钙,氢氧化钙再与碳酸钠反应生成碳酸钙和氢氧化钠,过滤得氢氧化钠的溶液,进行蒸发操作后可得氢氧化钠固体,据此对过程进行分析判断即可.
【解答】解:(1)由分析可知x是水,化学式为H2O;
(2)生石灰可以由碳酸钙高温分解制得,其方程式为:CaCO3![]()
![]() CaO+CO2↑;
CaO+CO2↑;
(3)由分析知操作②是将溶液中的溶质氢氧化钠和水进行分离,所采用的操作是蒸发结晶,由于反应池中氢氧化钙过量,所以经过这样的操作后所得固体中可能含有少量的氢氧化钙;如果不慎将碱液沾到皮肤上,可用较多的水冲洗,再涂上稀硼酸溶液对碱液进行中和,从而减轻碱液对皮肤的腐蚀;
(4)由于滤渣来自于氢氧化钠和氢氧化钙的溶液,所以经洗涤过滤后所得的滤液中一定会含有氢氧化钠和氢氧化钙,直接排放会导致浪费和污染环境;循环再利用,可有效的降低生产成本和防止
环境污染;
故答案为:(1)H2O;(2)碳酸钙;CaCO3![]()
![]() CaO+CO2↑;(3)蒸发;Ca(OH)2;硼酸;(4)污染环境;
CaO+CO2↑;(3)蒸发;Ca(OH)2;硼酸;(4)污染环境;
【点评】此题是一道框题推断分析题,其主干就是工业上制取烧碱的方法,只要能依据氢氧化钠是由碳酸钠和氢氧化钙制取的原理进行分析,即可得相应的问题答案.