е®һйӘҢжҳҜеҢ–еӯҰз ”з©¶зҡ„дёҖз§ҚйҮҚиҰҒжүӢж®өпјҢзҺ°жңүеҰӮеӣҫжүҖзӨәAпҪһGдёғз§Қд»ӘеҷЁпјҢиҜ·ж №жҚ®иҰҒжұӮеЎ«з©әгҖӮ
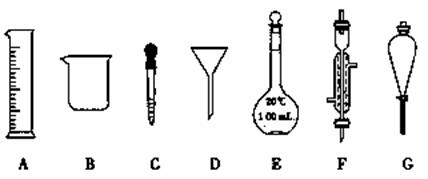
(1)еҶҷеҮәд»ӘеҷЁеҗҚз§°пјҡD________пјҢF________гҖӮ
(2)дёӢеҲ—е®һйӘҢж“ҚдҪңдёӯз”ЁеҲ°д»ӘеҷЁGзҡ„жҳҜ________(еЎ«дёӢеҲ—йҖүйЎ№зҡ„зј–еҸ·еӯ—жҜҚ)гҖӮ]
aпјҺеҲҶзҰ»ж°ҙе’ҢCCl4зҡ„ж··еҗҲзү©В В В В В В bпјҺеҲҶзҰ»ж°ҙе’Ңй…’зІҫзҡ„ж··еҗҲзү©В В cпјҺеҲҶзҰ»ж°ҙе’ҢжіҘжІҷзҡ„ж··еҗҲзү©
(3) е®һйӘҢе®ӨйңҖиҰҒй…ҚеҲ¶450mL 0.4 mol/Lзҡ„зЎ«й…ёжә¶ж¶ІгҖӮ
в‘ й…ҚеҲ¶ж—¶пјҢе®һйӘҢе®ӨжҸҗдҫӣдәҶд»ҘдёӢд»ӘеҷЁпјҡзғ§жқҜгҖҒ100mLйҮҸзӯ’гҖҒзҺ»з’ғжЈ’гҖҒжүҳзӣҳеӨ©е№іпјҲеёҰз қз ҒпјүгҖҒиғ¶еӨҙж»ҙз®ЎпјҢиҝҳзјәе°‘зҡ„зҺ»з’ғд»ӘеҷЁжҳҜВ В В В В В В В В В В В В В В В В В В В В В В гҖӮдёҠиҝ°е®һйӘҢдёӯдҪҝз”Ёе®№йҮҸ瓶еүҚеҝ…йЎ»иҝӣиЎҢзҡ„ж“ҚдҪңжҳҜВ В В В В В В В В В В В В В В В В В
в‘Ўй…ҚеҲ¶иҜҘжә¶ж¶ІйңҖз”Ё98п№Әзҡ„жө“зЎ«й…ёпјҲеҜҶеәҰдёә1.8g/mLпјү_______mLгҖӮеҸ–з”ЁиҜҘдҪ“з§Ҝжө“зЎ«й…ёж—¶пјҢйңҖиҰҒз”ЁеҲ°дёҠиҝ°д»ӘеҷЁдёӯзҡ„Aе’Ң________(еЎ«д»ӘеҷЁзҡ„зј–еҸ·еӯ—жҜҚ)гҖӮ
в‘ўдёӢеҲ—ж“ҚдҪңдјҡдҪҝй…ҚеҲ¶зҡ„жә¶ж¶Іжө“еәҰеҒҸй«ҳзҡ„жҳҜ________(еЎ«дёӢеҲ—йҖүйЎ№зҡ„зј–еҸ·еӯ—жҜҚ)гҖӮ
AпјҺиҪ¬з§»иҝҮзЁӢдёӯжңүе°‘йҮҸжә¶ж¶Іжә…еҮә
BпјҺжІЎжңүеҶ·еҚҙпјҢз«ӢеҚіиҪ¬з§»еҲ°е®№йҮҸ瓶дёӯе®ҡе®№
CпјҺж‘ҮеҢҖеҗҺпјҢж¶ІйқўдёӢйҷҚпјҢиЎҘе……ж°ҙ
DпјҺе®ҡе®№ж—¶дҝҜи§ҶеҲ»еәҰзәҝ
EпјҺйҮҸзӯ’йҮҸеҸ–жө“зЎ«й…ёжҳҜд»°и§ҶеҲ»еәҰзәҝ
гҖҗзӯ”жЎҲгҖ‘(1) жјҸж–—пјҢеҶ·еҮқз®Ўпјӣ (2) aпјӣ(3)В в‘ 500mLе®№йҮҸ瓶пјҢВ жЈҖйӘҢжҳҜеҗҰжјҸж°ҙпјӣ в‘Ў11.1пјҢCпјӣв‘ўBDEгҖӮ
гҖҗи§ЈжһҗгҖ‘
иҜ•йўҳеҲҶжһҗпјҡпјҲ1пјүDдёәжјҸж–—пјҢFдёәеҶ·еҮқз®ЎпјӣпјҲ2пјүGдёәеҲҶж¶ІжјҸж–—пјҢз”ЁдәҺиҗғеҸ–еҲҶж¶ІгҖҒеҗ‘е®№еҷЁдёӯж·»еҠ ж¶ІдҪ“пјҢaгҖҒдә’дёҚзӣёжә¶дёӨз§Қж¶ІдҪ“пјҢйҮҮз”ЁеҲҶж¶Іж–№жі•еҲҶзҰ»пјҢж•…жӯЈзЎ®пјӣbгҖҒдә’жә¶зҡ„дёӨз§Қж¶ІдҪ“пјҢдёҚиғҪз”ЁеҲҶж¶ІеҲҶзҰ»пјҢж•…й”ҷиҜҜпјӣcгҖҒз”ЁиҝҮж»Өж–№жі•еҲҶзҰ»пјҢж•…й”ҷиҜҜпјӣпјҲ3пјүв‘ ж №жҚ®й…ҚеҲ¶дёҖе®ҡзү©иҙЁзҡ„йҮҸжө“еәҰзҡ„жә¶ж¶Ід»ҘеҸҠе®№йҮҸ瓶зҡ„и§„ж јпјҢзјәе°‘500mLе®№йҮҸ瓶пјҢе®№йҮҸ瓶еңЁдҪҝз”ЁеүҚйҰ–е…ҲжЈҖйӘҢжҳҜеҗҰжјҸж¶Іпјӣв‘Ўж №жҚ®зЁҖйҮҠеүҚеҗҺжә¶иҙЁзҡ„иҙЁйҮҸе’Ңзү©иҙЁзҡ„йҮҸдёҚеҸҳпјҢеӣ жӯӨжңүV(H2SO4)Г—1.8Г—98%/98=500Г—10пјҚ3Г—0.4пјҢи§Јеҫ—V(H2SO4)= 11.1mLпјҢеҸ–з”Ёжө“зЎ«й…ёж—¶йңҖиҰҒз”ЁйҮҸзӯ’е’Ңиғ¶еӨҙж»ҙз®ЎпјҢеҚіCпјӣв‘ўж №жҚ®c=m/MV=n/VпјҢAгҖҒиҪ¬з§»ж—¶жңүе°‘йҮҸж¶ІдҪ“жә…еҮәпјҢйҖ жҲҗе®№йҮҸ瓶еҶ…пјҢжә¶иҙЁиҙЁйҮҸеҮҸе°‘пјҢжө“еәҰеҒҸдҪҺпјҢж•…й”ҷиҜҜпјӣBгҖҒжІЎжңүеҶ·еҚҙпјҢе°ұе®ҡе®№пјҢжҒўеӨҚеҲ°е®Өжё©дёӢпјҢжә¶ж¶ІдҪ“з§ҜеҮҸе°ҸпјҢжө“еәҰеҒҸй«ҳпјҢж•…жӯЈзЎ®пјӣCгҖҒж‘ҮеҢҖеҗҺпјҢиЎҘе……ж°ҙпјҢеҜ№жә¶ж¶ІиҝӣиЎҢзЁҖйҮҠпјҢжө“еәҰеҒҸдҪҺпјҢж•…й”ҷиҜҜпјӣDгҖҒе®ҡе®№ж—¶пјҢдҝҜи§ҶеҲ»еәҰзәҝпјҢжә¶ж¶Ізҡ„дҪ“з§ҜеҒҸе°ҸпјҢжө“еәҰеҒҸй«ҳпјҢж•…жӯЈзЎ®пјӣEгҖҒйҮҸзӯ’йҮҸеҸ–жө“зЎ«й…ёж—¶пјҢд»°и§ҶиҜ»ж•°пјҢжүҖйҮҸжө“зЎ«й…ёзҡ„дҪ“з§ҜеўһеӨ§пјҢжә¶иҙЁзү©иҙЁзҡ„йҮҸеўһеӨ§пјҢжө“еәҰеҒҸй«ҳпјҢж•…жӯЈзЎ®гҖӮ
иҖғзӮ№пјҡиҖғжҹҘе®һйӘҢд»ӘеҷЁзҡ„и®ӨиҜҶгҖҒзү©иҙЁеҲҶзҰ»гҖҒй…ҚеҲ¶дёҖе®ҡзү©иҙЁзҡ„йҮҸжө“еәҰзҡ„жә¶ж¶ІзӯүзҹҘиҜҶгҖӮ
В

