有关物质的转化关系如下图所示(无关物质已略去)。
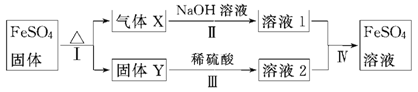
已知:①X由两种化合物组成,将X通入品红溶液,溶液退色;通入BaCl2溶液,产生白色沉淀。②Y是红棕色的化合物。
(1)气体X的成分是(填化学式)_______________________。
(2)反应Ⅰ的反应类型属于(填序号)________。
a.分解反应 b.复分解反应 c.置换反应 d.化合反应 e.氧化还原反应
(3)溶液2中金属阳离子的检验方法是________________ _________。
(4)若经反应 Ⅰ 得到16 g固体Y,产生的气体X恰好被0.4 L 1 mol·L-1 NaOH溶液完全吸收,则反应Ⅰ的化学方程式是___________________________ ,反应Ⅳ中生成FeSO4的离子方程式是____________________________________。
【答案】
(1)SO2、SO3(2)a、e(3)取少量溶液2于试管中,加入几滴KSCN试液,溶液变红色
(4)2FeSO4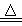 Fe2O3+SO2↑+SO3↑ 2Fe3++SO32-+H2O===2Fe2++SO42-+2H+
Fe2O3+SO2↑+SO3↑ 2Fe3++SO32-+H2O===2Fe2++SO42-+2H+
【解析】
试题分析:(1) X由两种化合物组成,将X通入品红溶液,溶液退色,说明有二氧化硫气体,;通入BaCl2溶液,产生白色沉淀,说明有三氧化硫,所以X为SO2、SO3;(2)反应一为硫酸亚铁受热分解,硫元素化合价降低,所以是氧化还原反应,所以选a、e。(3)根据硫元素化合价降低分析,有元素化合价升高,应该生成铁离子,所以溶液2中的阳离子应该为铁离子,检验铁离子可以使用硫氰化钾变红的性质,所以操作为取少量溶液2于试管中,加入几滴KSCN试液,溶液变红色。(4)16克固体Y即氧化铁为16/160=0.1摩尔,转移电子为0.2摩尔,对应的二氧化硫的物质的量为0.1摩尔,产生气体X恰好被0.4摩尔氢氧化钠吸收,说明三氧化硫和二氧化硫总0.2摩尔,即三氧化硫为0.1摩尔,根据物质的量比等于化学计量数比分析,方程式为:2FeSO4 Fe2O3+SO2↑+SO3↑.硫酸铁和亚硫酸钠反应生成硫酸亚铁和硫酸钠和硫酸,离子方程式为2Fe3++SO32-+H2O===2Fe2++SO42-+2H+
Fe2O3+SO2↑+SO3↑.硫酸铁和亚硫酸钠反应生成硫酸亚铁和硫酸钠和硫酸,离子方程式为2Fe3++SO32-+H2O===2Fe2++SO42-+2H+
考点:二氧化硫的性质,金属及其化合物的性质

