.亚硝酸钠(NaNO2)是重要的防腐剂。某化学兴趣小组尝试制备亚硝酸钠,查阅资料:①HNO2为弱酸,在酸性溶液中,NO2-可将MnO4-还原为Mn2+且无气体生成。
②NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸
探究一 亚硝酸钠固体的制备
以碳和浓硝酸为起始原料,设计如下装置利用一氧化氮与过氧化钠反应制备亚硝酸钠。(反应方程式为2NO+Na2O2=2NaNO2,部分夹持装置和A中加热装置已略)

(1)写出装置A烧瓶中发生反应的化学方程式 。
(2)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,为排除干扰应在B、C装置间增加装置E,E中盛放的试剂应是 (填字母)。
A.浓H2SO4 B.碱石灰 C.无水CaCl2
探究二 亚硝酸钠固体含量的测定及性质验证
称取装置C中反应后的固体4.000g溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000
mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
(3)第一组实验数据出现异常,造成这种异常的原因可能是 (填字母)。
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.滴定终了仰视读数
(4)根据表中数据,计算所得固体中亚硝酸钠的质量分数 。
(5)亚硝酸钠易溶于水,将0.2mol·L-1的亚硝酸钠溶液和0.1mol·L-1的盐酸等体积混合,混合后溶液呈酸性,则混合后溶液中离子浓度由大到小的顺序为 。
探究三 反应废液的处理
反应后烧瓶A中仍然存在一定量的硝酸,不能直接排放,用NaOH溶液调成中性,再用电化学降解法进行处理。25℃时,反应进行10min,溶液的pH由7变为12。电化学降解NO3-的原理如右图所示。
(6)电源正极为 (填A或B),阴极反应式为 。

【答案】(1)C +4HNO3 (浓) CO2↑+ 4NO2↑+ 2H2O (3分) (2)B(2分)
CO2↑+ 4NO2↑+ 2H2O (3分) (2)B(2分)
(3)A、C(2分)(4)86.25%(2分) (5)c(Na+)>c(NO2-)>c(Cl-)>c(H+)>c(OH-)(2分)
(6)A (2分) 2NO3- +6H2O +10e-=N2↑+12OH- (3分)
【解析】
试题分析:(1)浓硝酸既有强氧化性,能把单质碳氧化生成CO2,而硝酸被还原为NO2,同时还有水生成,因此装置A烧瓶中发生反应的化学方程式为C +4HNO3 (浓) CO2↑+ 4NO2↑+ 2H2O。
CO2↑+ 4NO2↑+ 2H2O。
(2)A装置中产生的NO2和CO2通入到B装置中,由于NO2溶于水生成NO和硝酸,在酸性条件下CO2的溶解度很小,因此从B装置中出来的NO气体中含有CO2以及水蒸气,二者与过氧化钠反应生成碳酸钠、氢氧化钠,因此要排出干扰,需要除去CO2和水蒸气。浓硫酸和氯化钙只能吸收水蒸气,碱石灰既可以吸收水蒸气,还能吸收CO2,因此答案选B。
(3)第一组实验与其它组实验相比,消耗高锰酸钾溶液的体积偏多。A、酸式滴定管用蒸馏水洗净后未用标准液润洗,则高锰酸钾溶液的浓度被稀释,因此消耗高锰酸钾溶液的体积增加,A正确;B、锥形瓶洗净后未干燥,不影响测定结果,B不正确;C、滴定终了仰视读数,则读数偏大,因此消耗高锰酸钾溶液的体积偏大,C正确,答案选AC。
(4)根据表中数据可知,三次实验中消耗高锰酸钾溶液体积的平均值=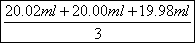 =20.00ml。在反应中Mn元素的化合价从+7价降低到+2价,得到5个电子。N元素的化合价从+3价升高到+5价,失去2个电子,因此根据电子得失守恒可知25.00mL待测液中亚硝酸钠的物质的量=0.1000
=20.00ml。在反应中Mn元素的化合价从+7价降低到+2价,得到5个电子。N元素的化合价从+3价升高到+5价,失去2个电子,因此根据电子得失守恒可知25.00mL待测液中亚硝酸钠的物质的量=0.1000
mol/L×0.0200L×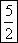 =0.00500mol,则原样品中亚硝酸钠的物质的量=0.00500mol×
=0.00500mol,则原样品中亚硝酸钠的物质的量=0.00500mol×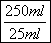 =0.0500mol,其质量=0.0500mol×69g/mol=3.45g,所以亚硝酸钠的质量分数=
=0.0500mol,其质量=0.0500mol×69g/mol=3.45g,所以亚硝酸钠的质量分数=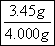 ×100%=86.25%。
×100%=86.25%。
(5)盐酸的酸性强于亚硝酸的,因此将0.2mol·L-1的亚硝酸钠溶液和0.1mol·L-1的盐酸等体积混合后生成亚硝酸、氯化钠,其中亚硝酸钠过量,且生成的亚硝酸与过量的亚硝酸钠以及氯化钠的物质的量浓度均相等,都是0.05mol/L。由于溶液显酸性,这说明亚硝酸的电离程度大于亚硝酸钠的水解程度,因此溶液中离子浓度大小关系是c(Na+)>c(NO2-)>c(Cl-)>c(H+)>c(OH-)。
(6)根据电解池可知,硝酸转化为氮气,氮元素的化合价降低,硝酸得到电子,被还原,因此Ag-Pt电极是阴极,则B是电源的负极,所以A是电源的正极。又因为25℃时,反应进行10min,溶液的pH由7变为12,这说明反应中有OH-产生,所以阴极电极反应式为2NO3- +6H2O +10e-=N2↑+12OH-。
考点:考查浓硝酸的性质、气体的净化、滴定实验判断、计算与误差分析、溶液中离子浓度大小比较以及电化学原理的应用与判断


