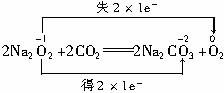用
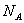
表示阿伏加德罗常数的值,判断下列说法的正误:
(1)7.8 g Na2O2与过量CO2反应时,转移的电子数为0.2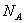
。
(2)在室温常压下,1 mol氖气含有的原子数为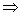
。
(3)1 mol白磷分子中所含共价键数为4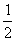
。
(4)常温常压下,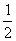
个CH
4分子的体积大于
22.4 L。
(5)标准状况下,22.4 L一氯甲烷和二氯甲烷的混合物所含分子数为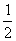
。
(6)只有在熔化时,1 mol NaCl中才含有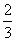
个Cl
-。
(7)1 mol金刚石和1 mol二氧化硅中所含C—C键、Si—O键数目均为2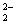
。
(8)在电解食盐水的实验中,测得电解后溶液的pH为14,又知电解后溶液总体积为1 L,则阴极析出的气体的分子数为0.5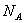
。
(9)在常温常压下,46 g NO2和N2O4混合物中所含原子的个数为3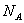
。
(10)1 mol苯分子中含有的碳碳双键数为3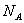
。
(11)常温常压下,1 mol NO2气体与水在无氧条件下反应生成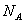
个NO
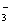
。
(12)1 mol·L-1的醋酸钠溶液中含CH3COOH、CH3COO-共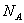
个。
(13)1 L 1 mol·L-1醋酸溶液中离子总数为2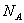
。
(14)6.8 g熔融的KHSO4中含有0.1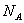
个阳离子。
(15)7.8 g Na2O2固体中所含离子的总数为0.3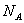
。
(16)电解精炼铜时转移0.1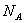
个电子时阳极溶解
3.2 g铜。
(17)23.4 g NaCl晶体中含有0.1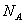
个图3-1所示的结构单元。
图3-1
(1)错。Na2O2与CO2反应时1 mol Na2O2转移1 mol e-。
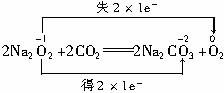
(2)对。氖气等稀有气体是单原子分子。
(3)错。白磷是由4个磷原子构成的正四面体结构,六条边对应每个分子中有六个共价键。
(4)对。标准状况下(0 ℃,1.01×105 Pa)1 mol气体的体积约为22.4 L,变到常温常压(25 ℃,1.01×105 Pa)是升高温度,气体体积增大。
(5)错。一氯甲烷是气体,二氯甲烷、三氯甲烷、四氯甲烷都是液体。
(6)错。NaCl是离子晶体,在任何状态下都含有Na+和Cl-。
(7)错。金刚石中每个碳原子与另外4个碳原子结合,平均每个碳原子有2个共价键,1 mol金刚石中含C—C键2na;二氧化硅中每个硅原子与4个氧原子结合,1 mol二氧化硅含Si—O键4NA。
(8)对pH=14
c(OH
-)=1 mol·L
-1,由关系2H
+~2e
-~2OH
-~H
2知
n(H
2)=
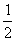 n
n(H
+)
无=
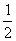 n
n(OH
-)
生=
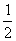
×1 mol·L
-1×1 L=0.5 mol,所以阴极析出0.5N
A个H
2。
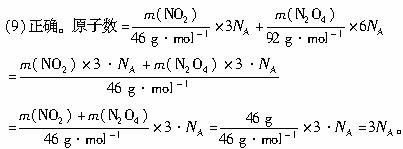
(10)错误。苯分子中无碳碳双键。
(11)错误。3NO2+H2O2HNO3+NO,1 mol NO2与水反应只生成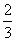
mol HNO
3。
(12)错误。没有溶液体积,不能求出溶质的物质的量。
(13)错误。CH3COOH是弱电解质,只有部分电离。
(14)错误。熔融的KHSO4中只有K+是阳离子,KHSO4K++HSO-4。
(15)正确。Na2O2中的离子为Na+、O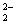
。
(16)错误。电解精炼铜时阳极除了Cu失电子外,还有比Cu活泼的杂质Fe、Zn。
(17)正确。1个NaCl晶胞中含4个NaCl单元,23.4 g NaCl晶体含晶胞单元为
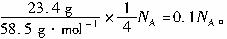
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()