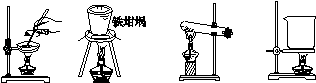铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。
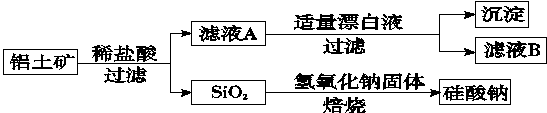
(1)在滤液A中加入漂白液,所得滤液B显酸性。
①滤液A中加入漂白液的目的是_______________(用离子方程式表示)。
②将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为_______(填代号)。
A.氢氧化钠溶液 B.硫酸溶液 C.氨水 D.二氧化碳
(2)由滤液B制备少量无水AlCl3(AlCl3极易在空气中水解)。
①由滤液B制备氯化铝晶体(将AlCl3·6H2O)涉及的操作为_____________、冷却结晶、__________(填操作名称)、洗涤。
②将AlCl3·6H2O溶于浓硫酸进行蒸馏,也能得到一定量的无水AlCl3,此原理是利用浓硫酸下列性质中的________(填序号)。
A.氧化性 B.吸水性 C.脱水性
(3)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为_________(填代号)。
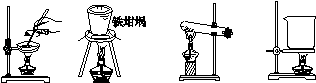
A B C D
【答案】(1)①2Fe2++ClO-+2H+===2Fe3++Cl-+H2O,
Fe3++3ClO-+3H2O===Fe(OH)3↓+3HClO(2分) ②C(2分)
(2)①边滴加浓盐酸边蒸发浓缩(1分) 过滤(1分) ②BC(2分)(3)B(2分)
【解析】
试题分析:(1)①滤液A中含有亚铁离子,加入漂白液的目的氧化亚铁离子,另外滤液A中加入漂白液,所得滤液B显酸性,这是有沉淀析出,所以另一个作用是为了沉淀铁离子,答案为:2Fe2++ClO-+2H+===2Fe3++Cl-+H2O;Fe3++3ClO-+3H2O===Fe(OH)3↓+3HClO;②将滤液B中的铝元素以沉淀形式析出,应该以氢氧化铝的形式析出,应该加碱,但是氢氧化钠合一和氢氧化铝反应,所以选用氨水,答案为:C;(2)①由滤液B制备氯化铝晶体(将AlCl3·6H2O),应该用结晶的方法,但是AlCl3极易在空气中水解,所以要在HCl氛围下加热,答案为:边滴加浓盐酸边蒸发浓缩;过滤;②将AlCl3·6H2O溶于浓硫酸进行蒸馏,也能得到一定量的无水AlCl3主要是由于浓硫酸具有吸水性和脱水性,可以防止铝离子水解,答案为BC;(3)SiO2和NaOH焙烧制备硅酸钠,要求温度比较高,要用坩埚,答案为:B
考点:考查化学实验