A、B、C、D四种短周期元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体甲;D的L层电子数等于K、M两个电子层上的电子数之和.
(1)写出A的原子结构示意图 .
(2)D的质子数和中子数相等,D的原子组成符号为 .
(3)用电子式表示A、D两元素形成AD2的过程: ;写出C2B2的电子式 .
(4)氢元素与B、D 均可以形成原子个数比为2:1的化合物,H2B的熔沸点高于H2D的原因是 .
(5)写出甲和A的最高价氧化物反应的化学方式: .
考点: 位置结构性质的相互关系应用.
分析: A、B、C、D为四种短周期元素,原子序数依次增大,B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体甲,固体甲为Na2O2,则B为O元素、C为Na元素;A的原子序数小于B,且A原子的最外层上有4个电子,则A为C元素;D的L层电子数等于K、M两个电子层上电子数之和,则D原子M层电子数为8﹣2=6,则D为S元素,据此解答.
解答: 解:A、B、C、D为四种短周期元素,原子序数依次增大,B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体甲,固体甲为Na2O2,则B为O元素、C为Na元素;A的原子序数小于B,且A原子的最外层上有4个电子,则A为C元素;D的L层电子数等于K、M两个电子层上电子数之和,则D原子M层电子数为8﹣2=6,则D为S元素.
(1)由上述分析可知,A为C元素,原子结构示意图为: ,故答案为:
,故答案为: ;
;
(2)D为S元素,原子的质子数和中子数相等,质量数为32,D的原子组成符号为3216S,故答案为:3216S;
(3)A、D两元素形成CO2,用电子式表示其形成过程为: ,
,
C2B2为Na2O2,电子式是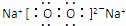 ,
,
故答案为: ;
;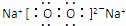 ;
;
(4)氢元素与O、S均可以形成原子个数比为2:1的化合物分别为H2O、H2S,由于H2O分子之间存在氢键,故H2O的沸点高于H2S,
故答案为:H2O分子之间存在氢键;
(5)二氧化碳与过氧化钠反应生成碳酸钠与氧气,化学反应方程式为:2Na2O2+CO2=2Na2CO3+O2,
故答案为:2Na2O2+CO2=2Na2CO3+O2.
点评: 本题考查结构性质位置关系应用,侧重对化学用语的考查,比较基础,注意对基础知识的积累掌握.

