在一密闭容器中加入A、B、C三种气体,保持温度一定,在t1~t4时刻测得各物质的浓度如表.据此判断下列结论正确的是( )
| 测定时刻/s | t1 | t2 | t3 | t4 |
| c(A)/(mol•L﹣1) | 6 | 3 | 2 | 2 |
| c(B)/(mol•L﹣1) | 5 | 3.5 | 3 | 3 |
| c(C)/(mol•L﹣1) | 1 | 2.5 | 3 | 3 |
| | A. | 在t3时刻反应已经停止 |
| | B. | A的转化率比B的转化率低 |
| | C. | 该温度下此可逆反应平衡常数K=4 |
| | D. | 该反应的化学方程式为2A(g)+B(g)⇌C(g) |
考点:
化学平衡的计算. | | 专题: | 化学平衡专题. |
| 分析: | A、t3时刻达到了平衡状态,反应没有停止; B、t1到t2,A、B分别消耗了3mol/L、1.5mol/L,同时生成了1.5mol/L的C,反应关系为:2A+B⇌C,极值转化反应前A的浓度为8mol/L、B为6mol/L; C、t3达到平衡状态,结合平衡浓度计算平衡常数; D、t1到t2,A、B分别消耗了3mol/L、1.5mol/L,同时生成了1.5mol/L的C,反应关系为:2A+B⇌C. |
| 解答: | 解:A、可逆反应达到了平衡状态,但是反应仍然进行,故A错误; B、t1到t2,A、B分别消耗了3mol/L、1.5mol/L,同时生成了1.5mol/L的C,反应关系为:2A(g)+B(g)⇌C(g),极值转化反应前A的浓度为8mol/L、B为6mol/L,A的转化率=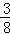 ×100%=37.5%,B的转化率= ×100%=37.5%,B的转化率=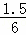 ×100%=25%,A的转化率大于B的转化率,故B错误; ×100%=25%,A的转化率大于B的转化率,故B错误; C、反应关系为:2A(g)+B(g)⇌C(g),平衡常数=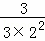 =0.25,故C错误; =0.25,故C错误; D、t1到t2,A、B分别消耗了3mol/L、1.5mol/L,同时生成了1.5mol/L的C,反应关系为:2A(g)+B(g)⇌C(g),故D正确; 故选D. |
| 点评: | 本题考查化学反应速率、平衡常数的计算及反应方程式的求算,注意平衡状态,反应没有停止,难度中等. |
