一定温度下,10mL0.40mol/L H2O2溶液发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 |  17.2 17.2
| 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A.0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<3.3×10-2mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
【答案】C
【解析】10mL溶液中含有H2O2物质的量为0.01L×0.4mol/L=0.004mol,
6min时,氧气的物质的量为0.0224L÷22.4L/mol=0.001mol,
根据三段法解题:
2H2O2 2H2O+O2↑
2H2O+O2↑
初始物质的量(mol) 0.004 0
变化的物质的量(mol) 0.002 0.001
6min时物质的量(mol) 0.002 0.001
则0~6min时间内,△c(H2O2)=0.002mol÷0.01L=0.2mol/L,
所以v(H2O2)=0.2mol/L÷6min≈3.3×10-2mol/(L·min),故A正确;
6min时,c(H2O2)=0.002mol÷0.01L=0.2mol/L,故C错误;
6min时,H2O2分解率为: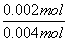 ×100%=50%,故D正确;
×100%=50%,故D正确;
随着反应的进行,H2O2的浓度逐渐减小,又由于反应物的浓度越小,反应速率越慢,所以6~10min的平均反应速率小于前6min的平均速率,即<3.3×10-2mol/(L·min),故B正确;
答案为C。
 【命题意图】本题考查化学反应速率的计算、一段时间反应物的浓度及分解率等知识,考察了学生对三段式解题的运用以及化学反应速率的影响因素的理解。
【命题意图】本题考查化学反应速率的计算、一段时间反应物的浓度及分解率等知识,考察了学生对三段式解题的运用以及化学反应速率的影响因素的理解。
