将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s) 2G(g),忽略
将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s) 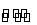 2G(g),忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
2G(g),忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
| 压强/MPa体积分数/%温度/℃ | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
①b<f
②915℃、2.0 MPa时E的转化率为60.0%
③该反应的ΔS>0
④K(1 000℃)>K(810℃)
上述①~④中正确的有( )
A.4个 B.3个 C.2个 D.1个
【解析】选A。从所给反应E(g)+F(s)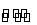 2G(g)可知,该反应是一个体积增大的反应,即ΔS>0,③正确;结合表中数据“54.0”“75.0”“83.0”,这个过程是压强增大(平衡向逆反应方向移动,G的体积分数减小)和温度升高的过程,所以温度升高平衡一定向正反应方向移动,正反应是吸热反应,即温度升高,化学平衡常数增大,④正确;根据以上分析,b小于54.0,f大于83.0,所以b<f,即①正确;设915℃、2.0 MPa时E的转化率为x,
2G(g)可知,该反应是一个体积增大的反应,即ΔS>0,③正确;结合表中数据“54.0”“75.0”“83.0”,这个过程是压强增大(平衡向逆反应方向移动,G的体积分数减小)和温度升高的过程,所以温度升高平衡一定向正反应方向移动,正反应是吸热反应,即温度升高,化学平衡常数增大,④正确;根据以上分析,b小于54.0,f大于83.0,所以b<f,即①正确;设915℃、2.0 MPa时E的转化率为x,
由 E(g) + F(s) 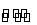 2G(g)
2G(g)
起始物质的量
浓度(mol·L-1) 1 0
转化物质的量
浓度(mol·L-1) x 2x
平衡物质的量
浓度(mol·L-1) 1-x 2x
则有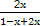 ×100%=75.0%,解得x=0.6,即E的转化率为60.0%,②正确。
×100%=75.0%,解得x=0.6,即E的转化率为60.0%,②正确。
![]() 2G(g),忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
2G(g),忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示: