硝酸是氧化性酸,其本质是NO3-有氧化性,某课外实验小组进行了下
硝酸是氧化性酸,其本质是NO3-有氧化性,某课外实验小组进行了下列有关NO3-氧化性的探究(实验均在通风橱中完成)。
| 实验装置 | 编号 | 溶液X | 实验现象 |
| 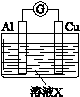
| 实验Ⅰ | 6 mol·L-1稀硝酸 | 电流计指针向右偏转,铜片表面产生无色气体,在液面上方变为红棕色。 |
| 实验Ⅱ | 15 mol·L-1浓硝酸 | 电流计指针先向右偏转,很快又偏向左边,铝片和铜片表面产生红棕色气体,溶液变为绿色。 |
(1)实验Ⅰ中,铝片作____________(填“正”或“负”)极。液面上方产生红棕色气体的化学方程式是________ _____________________________________________________。
(2)实验Ⅱ中电流计指针先偏向右边后偏向左边的原因是________________。
查阅资料:活泼金属与1 mol·L-1稀硝酸反应有H2和NH4+生成,NH4+生成的原理是产生H2的过程中NO3-被还原。
(3)用上图装置进行实验Ⅲ:溶液X为1 mol·L-1稀硝酸溶液,观察到电流计指针向右偏转。
① 反应后的溶液中含NH4+。实验室检验NH4+的方法是________。
② 生成NH4+的电极反应式是________。
(4)进一步探究碱性条件下NO3-的氧化性,进行实验Ⅳ:
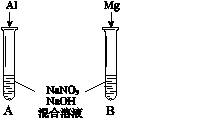

① 观察到A中有NH3生成,B中无明显现象。A、B产生不同现象的解释是________。
② A中生成NH3的离子方程式是________。
(5)将铝粉加入到NaNO3溶液中无明显现象,结合实验Ⅲ和Ⅳ说明理由________。
【答案】(1)负(1分) 2NO+O2=2NO2(1分)
(2)Al开始作电池的负极,Al在浓硝酸中迅速生成致密氧化膜后,Cu作负极(2分)
(3)① 取少量待检溶液于试管中,加入浓NaOH溶液,加热,若产生使湿润的红色石蕊试纸变蓝的气体,则溶液中含NH4+(2分)
② NO3-+8e-+10 H+=NH4++3H2O(2分)
(4)① Al与NaOH溶液反应产生H2的过程中可将NO3-还原为NH3,而Mg不能与NaOH溶液反应(2分)
② 8Al+3NO3-+5OH-+2H2O=3NH3↑+8AlO2-(2分)
(5)因为铝与中性的硝酸钠溶液无生成H2的过程,NO3-无法被还原(2分)
【解析】(1)实验Ⅰ中,由于Al的金属活动性比Cu强,因此Al做负极。铜片表面产生的无色气体是NO,在液体上方NO被空气中的氧气氧化成红棕色的NO2,方程式为2NO+O2=2NO2;(2)实验Ⅱ中, Al的金属活动性比Cu强,Al开始作电池的负极,电流计指针先偏向右边;由于Al在浓硝酸中迅速生成致密氧化膜,阻止了内层金属的进一步反应,因此,Cu作负极,电流计指针偏向左边;(3)①实验室检验NH4+有两种常用方法:方法一,取少量待检溶液于试管中,加入浓NaOH溶液,加热,若产生使湿润的红色石蕊试纸变蓝的气体,则溶液中含NH4+;方法二,取少量待检溶液于试管中,加入浓NaOH溶液,加热,并在试管口放一蘸有浓盐酸的玻璃棒,若有白烟生成,证明溶液中含NH4+;②NH4+的生成是NO3-被还原的结果,其电极反应式为NO3-+8e-+10 H+=NH4++3H2O(4)①观察到A中有NH3生成,是由于Al与NaOH溶液反应产生H2,并且与此同时,H2可将NO3-还原为NH3;B中无现象是由于Mg与NaOH溶液不反应;②A中生成NH3的离子方程式为 8Al+3NO3-+5OH-+2H2O=3NH3↑+8AlO2-;(5)铝与中性的硝酸钠溶液不能生成H2, NO3-无法被还原,因此将铝粉加入到NaNO3溶液中无明显现象



