某稀硫酸和稀硝酸的混合溶液 200mL ,平均分成两份。向其中一份中逐渐加入铜粉,最多能 溶解 l9.2g( 已知硝酸只被还原为 NO 气体,下同 ) 。向另一份中逐渐加入铁粉,产生气体的 量随铁粉质量增加的变化如图所示。下列说法正确的是 ( )
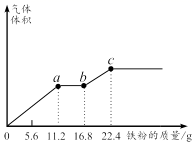
A . c 点时,溶液中的溶质为 Fe 2 (SO 4 ) 3
B . ab 段发生反应的离子方程式为: Fe+Fe 3+ =2Fe 2+
C . 原混和酸中稀硝酸的物质的量浓度为 0.4 mol/L
D . 原混和酸中稀硫酸的物质的量浓度为 4 mol/L
