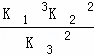已知同温同压下,下列反应的焓变和平衡常数分别表示为
H2(g)+ O2(g)=H2O(g)△H1 K1
O2(g)=H2O(g)△H1 K1
 N2(g)+O2(g)=NO2(g)△H2 K2
N2(g)+O2(g)=NO2(g)△H2 K2
 N2(g)+
N2(g)+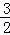 H2(g)=NH3(g)△H3 K3
H2(g)=NH3(g)△H3 K3
则反应2NH3(g)+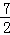 O2(g)=2NO2(g)+3H2O(g)的△H和K分别为( )
O2(g)=2NO2(g)+3H2O(g)的△H和K分别为( )
| | A. | 2△H1+2△H2﹣2△H3 3K1+2K2﹣2K3 |
| | B. | 2△H3﹣3△H1﹣2△H2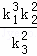 |
| | C. | 3△H1+2△H2﹣2△H3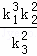 |
| | D. | 3△H1+2△H2﹣2△H3 3K1+2K2﹣2K3 |
考点:
反应热和焓变. | | 专题: | 化学反应中的能量变化. |
| 分析: | 根据盖斯定律进行计算,由①×3﹣③×2+②×2得出2NH3(g)+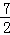 O2(g)=2NO2(g)+3H2O(g)的△H;根据平衡常数的表达式得出K与系数成幂次方关系,方程式相加即平衡常数相乘,方程式相减即平衡常数相除,以此分析; O2(g)=2NO2(g)+3H2O(g)的△H;根据平衡常数的表达式得出K与系数成幂次方关系,方程式相加即平衡常数相乘,方程式相减即平衡常数相除,以此分析; |
| 解答: | 解:已知同温同压下,下列反应的焓变和平衡常数分别表示为 ①H2(g)+ O2(g)=H2O(g)△H1 K1 O2(g)=H2O(g)△H1 K1 ②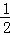 N2(g)+O2(g)=NO2(g)△H2 K2 N2(g)+O2(g)=NO2(g)△H2 K2 ③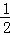 N2(g)+ N2(g)+ H2(g)=NH3(g)△H3 K3 H2(g)=NH3(g)△H3 K3 则2NH3(g)+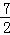 O2(g)=2NO2(g)+3H2O(g)由①×3﹣③×2+②×2得到,所以△H=3△H1+2△H2﹣2△H3; O2(g)=2NO2(g)+3H2O(g)由①×3﹣③×2+②×2得到,所以△H=3△H1+2△H2﹣2△H3; 根据平衡常数K与系数成幂次方关系,方程式相加即平衡常数相乘,方程式相减即平衡常数相除,又由2NH3(g)+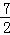 O2(g)=2NO2(g)+3H2O(g)由①×3﹣③×2+②×2得到,则K= O2(g)=2NO2(g)+3H2O(g)由①×3﹣③×2+②×2得到,则K=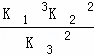 ;故选:C; ;故选:C; |
| 点评: | 本题主要考查了盖斯定律的应用及其平衡常数的转换关系,难度不大,需要细心计算即可; |
![]() O2(g)=H2O(g)△H1 K1
O2(g)=H2O(g)△H1 K1![]() N2(g)+O2(g)=NO2(g)△H2 K2
N2(g)+O2(g)=NO2(g)△H2 K2![]() N2(g)+
N2(g)+![]() H2(g)=NH3(g)△H3 K3
H2(g)=NH3(g)△H3 K3![]() O2(g)=2NO2(g)+3H2O(g)的△H和K分别为( )
O2(g)=2NO2(g)+3H2O(g)的△H和K分别为( )