在温度T1和T2时,分别将0.50mol CH4和1.20mol NO2充入体积为1L的密闭容器中,发生如下反应:CH4(g)+2NO2(g)⇌N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如表:下列说法正确的是( )
| | 时间/min | 0 | 10 | 20 | 40 | 50 |
| T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | … | 0.15 |
A.T1时0~10 min NO2的平均反应速率为0.15 mol•L﹣1•min﹣1
B.T2时CH4的平衡转化率为70.0%
C.保持其他条件不变,T1时向平衡体系中再充入0.30 mol CH4和0.80 mol H2O(g),平衡向正反应方向移动
D.保持其他条件不变,T1时向平衡体系中再充入0.50 mol CH4和1.20 mol NO2,与原平衡相比,达新平衡时N2的浓度增大
【分析】A.结合v=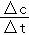 及速率之比等于化学计量数之比计算;
及速率之比等于化学计量数之比计算;
B.由表格数据可知,T2时CH4的平衡物质的量为0.15mol,则转化的甲烷为0.50mol﹣0.15mol=0.35mol;
C.T1时,体积为1L,由表格中数据可知,
CH4(g)+2NO2(g)⇌N2(g)+CO2(g)+2H2O(g)
开始 0.5 1.2 0 0 0
转化 0.4 0.8 0.4 0.4 0.8
平衡 0.1 0.4 0.4 0.4 0.8
K=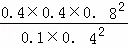 =6.4,
=6.4,
T1时向平衡体系中再充入0.30 mol CH4和0.80 mol H2O(g),比较Qc、K,判断反应进行方向;
D.体积不变,物质的量变为原来的2倍,若平衡不移动,则平衡浓度变为原平衡的2倍,但压强增大平衡逆向移动.
【解答】解:A.T1时0~10 min CH4的平均反应速率为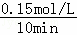 =0.015 mol•L﹣1•min﹣1,由速率之比等于化学计量数之比可知,T1时0~10 min NO2的平均反应速率为0.03 mol•L﹣1•min﹣1,故A错误;
=0.015 mol•L﹣1•min﹣1,由速率之比等于化学计量数之比可知,T1时0~10 min NO2的平均反应速率为0.03 mol•L﹣1•min﹣1,故A错误;
B.由表格数据可知,T2时CH4的平衡物质的量为0.15mol,则转化的甲烷为0.50mol﹣0.15mol=0.35mol,则T2时CH4的平衡转化率为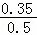 ×100%=70.0%,故B正确;
×100%=70.0%,故B正确;
C.T1时,体积为1L,由表格中数据可知,
CH4(g)+2NO2(g)⇌N2(g)+CO2(g)+2H2O(g)
开始 0.5 1.2 0 0 0
转化 0.4 0.8 0.4 0.4 0.8
平衡 0.1 0.4 0.4 0.4 0.8
K=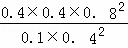 =6.4,
=6.4,
T1时向平衡体系中再充入0.30 mol CH4和0.80 mol H2O(g),Qc=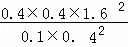 =25.6>K,则平衡逆向移动,故C错误;
=25.6>K,则平衡逆向移动,故C错误;
D.体积不变,物质的量变为原来的2倍,若平衡不移动,则平衡浓度变为原平衡的2倍,但压强增大平衡逆向移动,则达新平衡时N2的浓度增大,大于原平衡浓度小于原平衡浓度的2倍,故D正确;
故选:BD。
【点评】本题考查化学平衡的计算,为高频考点,把握表格中数据、平衡三段法、Qc与K的计算为解答的关键,侧重分析与计算能力的考查,注意选项C为解答的难点,题目难度不大.
