(15分) ![]() I.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
I.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
![]()
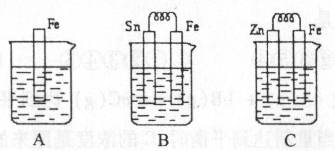
(1)A中反应的离子方程式为 ;
(2)B中Sn极的电极反应式为 ,Sn极附近溶液的pH (填“增大”、“减小”或“不变”);
(3)C中被腐蚀的金属是 ,总反应式为 比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是
II.现有常温下的6份溶液:①0.01 mol・L-1CH3COOH溶液;②0.01 mol・L-1HCl溶液;③pH=13的氨水;④pH=13的NaOH溶液;⑤0.01 mol・ L-1CH3COOH溶液与pH=12的NaOH等体积混合后所得溶液;⑥0.01 mol・L-1HCI溶液与pH=12的NaOH溶液等体积混合所得溶液。
(1)其中水的电离程度最大的是 (选填序号,下同),水的电离程度相同的是 ;
(2)若将②、④混合后所得溶液pH=12,则消耗②、④溶液的体积之比为 ;
(3)将溶液同等稀释10倍后溶液的pH:③ ④,⑤ ⑥(选填“>”或“<”或“=”)。
