еҸ–иҪҜй”°зҹҝзҹіпјҲдё»иҰҒжҲҗеҲҶдёәMnO2пјү116g и·ҹи¶ійҮҸжө“зӣҗй…ёеҸ‘з”ҹеҰӮдёӢеҸҚеә”(жқӮиҙЁ
еҸ–иҪҜй”°зҹҝзҹіпјҲдё»иҰҒжҲҗеҲҶдёәMnO2пјү116g и·ҹи¶ійҮҸжө“зӣҗй…ёеҸ‘з”ҹеҰӮдёӢеҸҚеә”(жқӮиҙЁдёҚеҸӮдёҺеҸҚеә”)MnO2+4HCl(жө“) MnCl2+Cl2вҶ‘+2H2OпјҢеҲ¶еҫ—22.4L Cl2пјҲж ҮеҮҶзҠ¶еҶөпјүгҖӮдёӢеҲ—жңүе…іиҜҙжі•дёӯдёҚжӯЈзЎ®зҡ„жҳҜ
MnCl2+Cl2вҶ‘+2H2OпјҢеҲ¶еҫ—22.4L Cl2пјҲж ҮеҮҶзҠ¶еҶөпјүгҖӮдёӢеҲ—жңүе…іиҜҙжі•дёӯдёҚжӯЈзЎ®зҡ„жҳҜ
A. иҝҷз§ҚиҪҜй”°зҹҝзҹідёӯMnO2зҡ„иҙЁйҮҸеҲҶж•°дёә75%
B. иў«ж°§еҢ–зҡ„HClзҡ„зү©иҙЁзҡ„йҮҸдёә4mol
C. еҸӮеҠ еҸҚеә”зҡ„HClзҡ„иҙЁйҮҸдёә146g
D. иў«иҝҳеҺҹзҡ„MnO2зҡ„зү©иҙЁзҡ„йҮҸдёә1mol
гҖҗзӯ”жЎҲгҖ‘B
гҖҗи§ЈжһҗгҖ‘
гҖҗиҜҰи§ЈгҖ‘AпјҺ22.4L Cl2пјҲж ҮеҮҶзҠ¶еҶөпјүзҡ„зү©иҙЁзҡ„йҮҸдёә1molпјӣж №жҚ®ж–№зЁӢејҸпјҢз”ҹжҲҗ1molж°Ҝж°”йңҖиҰҒ1mol MnO2еҸӮеҠ еҸҚеә”пјӣ1mol MnO2зҡ„иҙЁйҮҸдёә87gпјӣз”ҹжҲҗ1molж°Ҝж°”йңҖиҰҒ4molHClеҸӮеҠ еҸҚеә”пјӣMnO2зҡ„иҙЁйҮҸеҲҶж•°дёә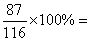 75%пјҢж•…AжӯЈзЎ®пјӣ
75%пјҢж•…AжӯЈзЎ®пјӣ
BпјҺиў«ж°§еҢ–зҡ„HClзҡ„зү©иҙЁзҡ„йҮҸдёәеҸӮеҠ еҸҚеә”зҡ„HClзҡ„дёҖеҚҠпјҢж•…Bй”ҷиҜҜпјӣ
C.еҸӮеҠ еҸҚеә”зҡ„HClзҡ„иҙЁйҮҸдёә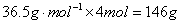 пјҢж•…CжӯЈзЎ®пјӣ
пјҢж•…CжӯЈзЎ®пјӣ
D.з”ҹжҲҗ1molж°Ҝж°”йңҖиҰҒ1mol MnO2еҸӮеҠ еҸҚеә”пјҢеҸӮеҠ еҸҚеә”зҡ„MnO2йғҪиў«иҝҳеҺҹпјҢж•…DжӯЈзЎ®гҖӮ
ж•…йҖүBгҖӮ
![]() MnCl2+Cl2вҶ‘+2H2OпјҢеҲ¶еҫ—22.4L Cl2пјҲж ҮеҮҶзҠ¶еҶөпјүгҖӮдёӢеҲ—жңүе…іиҜҙжі•дёӯдёҚжӯЈзЎ®зҡ„жҳҜ
MnCl2+Cl2вҶ‘+2H2OпјҢеҲ¶еҫ—22.4L Cl2пјҲж ҮеҮҶзҠ¶еҶөпјүгҖӮдёӢеҲ—жңүе…іиҜҙжі•дёӯдёҚжӯЈзЎ®зҡ„жҳҜ