通过近一年的化学学习,你已经掌握了实验室制取气体的有关规律.请结合提供的一些实验装置,回答下列问题:
资料:实验室常用氯化铵固体与碱石灰固体共热来制取氨气.常温下NH3是一种无色、有刺激性气味的气体,密度比空气小.NH3极易溶于水,其水溶液呈碱性.
(1)制取氨气的反应的方程式:2NH4Cl+Ca(OH)2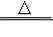
 CaCl2+2NH3↑+2X.X的化学式为: .
CaCl2+2NH3↑+2X.X的化学式为: .
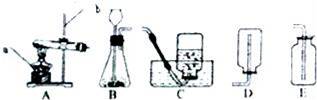
(2)制取并收集NH3,应从图中选择的装置是 .
(3)NH3是一种碱性气体,干燥时不能选用下列干燥剂中的 (填序号).
A.固体氢氧化钠 B.浓硫酸 C.生石灰.

【考点】常用气体的发生装置和收集装置与选取方法;根据浓硫酸或烧碱的性质确定所能干燥的气体;质量守恒定律及其应用.
【分析】(1)根据质量守恒定律的实质分析;
(2)根据药品的状态和反应条件选择发生装置,根据气体的密度和溶解性选择收集装置;
(3)氨气为碱性的物质,所以该物质的干燥剂为碱性,故可以据此解答该题.
【解答】解:(1)制取氨气反应的方程式:2NH4Cl+Ca(OH)2
 CaCl2+2NH3↑+2X.根据质量守恒定律可以知道反应前后原子的种类和个数相等,可以判断得出X的化学式为:H2O;
CaCl2+2NH3↑+2X.根据质量守恒定律可以知道反应前后原子的种类和个数相等,可以判断得出X的化学式为:H2O;
(2)用氯化铵固体与碱石灰固体共热来制取氨气,属于固体加热型,故选发生装置A,NH3密度比空气小,又极易溶于水,所以收集NH3只能用向下排空气法;
(3)干燥剂所干燥的气体必须不能与干燥剂发生反应,NH3是一种碱性气体,干燥时不能选用浓硫酸,因为浓硫酸能与氨气发生反应,故选B;
故答案为:(1)H2O;(2)AD;(3)B.
![]()
![]() CaCl2+2NH3↑+2X.X的化学式为: .
CaCl2+2NH3↑+2X.X的化学式为: .

