氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之
氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一.
(1)传统哈伯法合成氨工艺中,
①升高温度,正反应速率(V正) (填“增大”、“减小”或“不变”).
②若增大压强,N2的转化率 ;若已达平衡后再加入N2,N2的转化率减小(填“增大”、“减小”或“不变”).
③若加压到10×101.3KPa时,其它条件不变,发现平衡逆向移动,原因应该是
A.由于体积变大了,反应朝着体积增大方向移动
B.由于N2状态发生了变化
C.由于体积变小了,反应朝着体积增大方向移动
D.由于N2和H2的状态都发生了变化
E.由于H2状态发生了变化,N2状态可能发生变化也可能没有变化
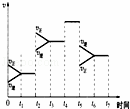
④如图表示上述反应在某一时间段中反应速率与反应过程的关系图.由图判断,NH3的百分含量最高的一段时间是 .
⑤据图判断反应在t2~t3这段时间内,曲线变化的原因是D,t5~t6时间内曲线变化的原因可能是B(以上均填编号).
A.加了催化剂 B.扩大容器的体积 C.降低温度 D.增大压强
⑥不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见表(N2和H2的起始物质的量之比为1:3 ).分析表中数据,200℃100MPa时H2转化率最高.
实际工业生产不选用该条件的主要原因是 .
 0.1 10 20 30 60 100
0.1 10 20 30 60 100
200 15.3 81.5 86.4 89.9 95.4 98.8
300 2.2 52.0 64.2 71.0 84.2 92.6
400 0.4 25.1 38.2 47.0 65.2 79.8
500 0.1 10.6 19.1 26.4 42.2 57.5
600 0.05 4.5 9.1 13.8 23.1 31.4
(2)最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法.它既有液氢燃料电池的优点,又克服了液氢不易保存的不足.其装置为用铂黑作为电极,加入电解质溶液中,一个电极通入空气,另一电极通入氨气.其电池反应为4NH3+3O2═2N2+6H2O.写出负极电极反应式 ,你认为电解质溶液应显 (填“酸性”、“中性”、“碱性”),其原因是 .
考点: 化学反应速率与化学平衡图象的综合应用;原电池和电解池的工作原理;化学平衡的影响因素.
专题: 基本概念与基本理论.
分析: (1)①升高温度,正逆反应速率均增大;
②N2+3H2 2NH3是气体体积减小的反应,增大压强,平衡正向移动;
2NH3是气体体积减小的反应,增大压强,平衡正向移动;
③增大压强,平衡向气体体积减小的方向移动;
④反应N2+3H2 2NH3向正反应方向移动,氨的量在增加,若反应向逆反应方向移动,则氨的量开始减小;
2NH3向正反应方向移动,氨的量在增加,若反应向逆反应方向移动,则氨的量开始减小;
⑤反应在t2~t3这段时间内正逆反应速率同时增大,正反应速率大于逆反应速率,t5~t6时间内,正逆反应速率同时减小,逆反应速率大于正反应速率;
⑥H2转化率最高时,氨气的含量最大;实际生成时要考虑生成成本、设备能否达到要求等方面;
(2)氨气为碱性气体,易与酸反应,应用碱性电解质,负极发生氧化反应.
解答: 解:(1)①升高温度,正逆反应速率均增大,
故答案为:增大;
②反应N2+3H2 2NH3是气体体积减小的反应,增大压强,平衡正向移动,N2的转化率增大,已达平衡后再加入N2,N2的转化率减小,
2NH3是气体体积减小的反应,增大压强,平衡正向移动,N2的转化率增大,已达平衡后再加入N2,N2的转化率减小,
故答案为:增大;减小;
③增大压强,平衡向气体体积减小的方向移 动,只能由于H2状态发生了变化,不再为气体,才能使左边体积减小,故E时可能的情况,
动,只能由于H2状态发生了变化,不再为气体,才能使左边体积减小,故E时可能的情况,
故答案为:E;
④在t3之前,正反应速率大于逆反应速率,平衡正向移动,氨的量在增加,当t5时,逆反应速率开始大于正反应速率,平衡逆向移动,氨的量开始减小,所以t3~t5时NH3的百分含量最高,故答案为:t3~t5;
⑤反应在t2~t3这段时间内正逆反应速率同时增大,正反应速率大于逆反应速率,平衡正向移动,故改变条件为增大压强,t5~t6时间内,正逆反应速率同时减小,逆反应速率大于正反应速率,平衡逆向移动 ,故改变条件为减小压强,即扩大容器的体积,
,故改变条件为减小压强,即扩大容器的体积,
故答案为:D;B;
⑥200℃、100MPa时氨气的含量最大,则H2转化率最高,但实际工业生产中压强不能太大,因压强太高,对生产设备要求也高,难以实现,且200℃时反应速率过低,
故答案为:200;100;压强太高,对生产设备要求也高,难以实现,且200℃时反应速率过低;
(2)氨气为碱性气体,易与酸反应,所以电解质溶液应呈碱性,负极发生氧化反应,氨气被氧化生产氮气,电极反应式为2NH3+6OH﹣﹣6e﹣=N2+6H2O,
故答案为:2NH3+60H﹣﹣6e﹣═N2+6H2O;碱性;NH3在酸性介质中易转化为NH4+离子;
点评: 本题考查化学平衡、电化学等知识,题目难度中等,本题影响化学平衡的因素,把握电极反应式的书写.
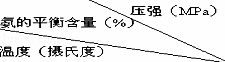 0.1 10 20 30 60 100
0.1 10 20 30 60 100
