相同温度下,体积均为1.5 L的两个恒容容器中发生可逆反应:X2g)+
相同温度下,体积均为1.5 L的两个恒容容器中发生可逆反应:X2g)+3Y2g)2XY3g) ΔH=-92.6 kJ·mol-1,实验测得有关数据如下表:
| 容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 |
| X2 | Y2 | XY3 |
| ① | 1 | 3 | 0 | 放热46.3 kJ |
| ② | 0.8 | 2.4 | 0.4 | QQ>0) |
下列叙述不正确的是 )。
A.容器①中达到平衡时,Y2的转化率为50%
B.Q=27.78 kJ
C.若容器①体积改为1.0 L,则达平衡时放出的热量大于46.3 kJ
D.容器①、②中反应的平衡常数相等,K=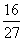
解析 由X2g)+3Y2g)2XY3g) ΔH=-92.6 kJ·mol-1可知3 mol Y2完全反应时,放出热量为92.6 kJ。发生反应的物质越多,放出的热量就越多。A项,①中达到平衡时,反应放热46.3 kJ。所以Y2的转化率为46.3 kJ÷92.6 kJ )×100%=50%,正确;B项,②中假如0.4 mol的XY3不是起始加入的,而是由X2、Y2反应生成的,则相当于起始投入量为X2=1 mol;Y2=3 mol。与①相同,则为等效平衡。根据A的分析可知平衡时Y2=1.5mol,转化量为2.4-1.5=0.9 mol,所以放出热量Q=0.9÷3)×92.6 kJ=27.78 kJ。正确;C项,若容器①体积改为1.0 L,则相当于给容器增大压强,由于该反应的正反应是气体体积减小的反应。根据平衡移动原理:
增大压强,化学平衡向气体体积减小的方向。所以达平衡时放出的热量大于46.3 kJ。正确;D项,容器①、②中反应是在相同温度下的同一个平衡状态,所以平衡常数相等,K=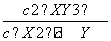 =
=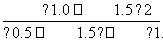 =
=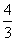 。错误。
。错误。
答案 D
![]()
