铁及其化合物有丰富多彩的化学性质。回答下列问题:
(1)铁元素在周期表中的位置为第_____周期第____族。
(2) FeCl3溶液可用于吸收尾气中的SO2,写出该反应的离子方程式:_____________。
(3)某化学兴趣小组同学用下图装置,充分加热硫酸亚铁晶体(FeSO4.xH2O)至完全分解。

①装置A中需持续通入N2,其目的是
②充分反应一段时间后,小组同学观察到实验现象为:装置A中残留有红棕色固体,装置B中固体变蓝,C中溶液褪色,请写出FeSO4分解的化学方程式:________。
③装置D中干燥管的作用为____。
④小组同学利用数字化实验仪器测定了不同温度时FeSO4.xH2O分解的质量变化情况,得到下
图关 系:
系:
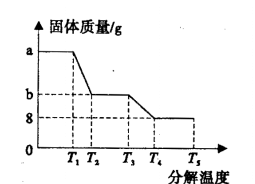
实验结束后后,装置B质量增加12. 6g,结合上图数据,确定FeSO4·xH2O中的x=
【答案】(1)四 Ⅷ (2分);(2)2Fe3++SO2+2H2O=2Fe2++SO42-+4H+(2分);(3)①持续充入氮气,可排 除装置中的空气,将晶体分解的气体产物全部从A中排出(2分);②2FeSO4  Fe2O3+SO2↑+SO3↑(2分);③防止氢氧化钠溶液倒吸(1分);④7 (2分)
Fe2O3+SO2↑+SO3↑(2分);③防止氢氧化钠溶液倒吸(1分);④7 (2分)
【解析】
试题分析:(1)Fe是26号元素,在元素周期表中位于第四周期,第Ⅷ族;(2)Fe3+有强的氧化性,在溶液中会将SO2氧化为硫酸,Fe3+被还原为Fe2+,S反应的离子方程式:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+。(3)①在反应开始前向装置A中需持续通入N2,其目的是可排除装置中的空气;当反应结束后再持续通入N2,其目的是 将晶体分解的气体产物全部从A中排出;②装置A中残留有红棕色固体,说明产物中有Fe2O3,装置B中固体变蓝,说明反应产生了H2O,装置C中高锰酸钾溶液褪色,说明产物中还有还原性是SO2气体生成,故结晶水分解逸出后的FeSO4分解产生了Fe2O3和SO2,根据氧化还原反应中电子转移数目相等及反应前后的元素守恒可其分解的化学方程式为:2FeSO4
将晶体分解的气体产物全部从A中排出;②装置A中残留有红棕色固体,说明产物中有Fe2O3,装置B中固体变蓝,说明反应产生了H2O,装置C中高锰酸钾溶液褪色,说明产物中还有还原性是SO2气体生成,故结晶水分解逸出后的FeSO4分解产生了Fe2O3和SO2,根据氧化还原反应中电子转移数目相等及反应前后的元素守恒可其分解的化学方程式为:2FeSO4  Fe2O3+ SO2↑+ SO3↑。③FeSO4分解产生SO2和SO3都是大气污染物,要用NaOH吸收,防止造成环境污染,若直接将导气管通入NaOH溶液中,气体溶解,使导气管中气体压强减小,烧杯的溶液会倒吸进入装置C,有干燥管,就可以防止氢氧化钠溶液倒吸;④根据图像可知,最终生成的氧化铁质量是8g,装置B增重12.6g,说明产物中水的质量为12.6g。根据2 FeSO4•xH2O ~Fe2O3~2xH2O,n(Fe2O3)= 8g÷160g/mol =0.05mol,n(Fe)=0.05mol×2=0.1mol;n(H2O)= 12.6g÷18g/mol=0.7mol,n(Fe): n(H2O)=0.1mol:0.7mol=1:7,根据物质的化学式可知n(Fe): n(H2O)=1:x,所以x=7。
Fe2O3+ SO2↑+ SO3↑。③FeSO4分解产生SO2和SO3都是大气污染物,要用NaOH吸收,防止造成环境污染,若直接将导气管通入NaOH溶液中,气体溶解,使导气管中气体压强减小,烧杯的溶液会倒吸进入装置C,有干燥管,就可以防止氢氧化钠溶液倒吸;④根据图像可知,最终生成的氧化铁质量是8g,装置B增重12.6g,说明产物中水的质量为12.6g。根据2 FeSO4•xH2O ~Fe2O3~2xH2O,n(Fe2O3)= 8g÷160g/mol =0.05mol,n(Fe)=0.05mol×2=0.1mol;n(H2O)= 12.6g÷18g/mol=0.7mol,n(Fe): n(H2O)=0.1mol:0.7mol=1:7,根据物质的化学式可知n(Fe): n(H2O)=1:x,所以x=7。
考点:考查物质的性质的验证的知识。

![]() 系:
系:
