. 某同学为探究铁合金中铁的质量分数,先后进行了三次实验,实验数据如下表:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 所取合金的质量/g | 20 | 20 | 40 |
| 所加稀硫酸的质量/g | 100 | 120 | 80 |
| 生成氢气的质量/g | 0.4 | 0.4 | 0.4 |
根据该同学的实验.试回答以下问题:
(1)上表三次实验中,合金里的铁恰好完全反应时,消耗稀硫酸溶液的质量是 g。
(2)该铜铁合金中铁的质量分数是多少?
(3)第三次实验所得溶液溶质质量分数为 。 (结果保留至0.1%)
【思路点拨】解题的关键是通过比较图表数据所表达的物质质量的变化规律,从中选取关键的数据(一般是恰好完全反应的数据或完全反应的物质),再利用其质量来进行解答。
【答案】 (1)80
(2)解:设20 g合金中含铁的质量为x,其恰好完全反应后生成硫酸亚铁的质量为y。
Fe+H2SO4=FeSO4+H2↑
56 152 2
x y 0.4 g
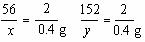
x=11.2 g y =30.4 g
该铜铁合金中铁的质量分数为:11.2 g÷20 g×100%=56%
(3)第三次实验所得溶液溶质质量分数为30.4 g÷(11.2 g+80g-0.4 g)×100%=33.5%
答:该铜铁合金中铁的质量分数为56%,第三次实验所得溶液溶质质量分数为33.5%。
【解析】比较第一次和第二次实验数据可以得出“第二次所用的稀硫酸过量,即合金完全反应”,比较第一次和第三次实验数据可以得出“第三次所用的合金过量,即稀硫酸完全反应”,因此得出关键的数据“20 g合金和80 g稀硫酸恰好完全反应”。
【总结升华】同学们在解答时容易出现的问题:
问题(1):有的同学数据分析出错,认为恰好完全反应的数据应该是同一次实验的数据,所以错选100 g,其实本题中出现的恰好完全反应的数据不是来自同一次实验,即三次实验没有一次是恰好完全反应的。问题(2):计算铜铁合金中铁的质量分数时,延用了第三次的数据,把合金质量当成了40g,没有注意到40 g合金中的铁并没有完全反应。
问题(3):计算第三次实验所得溶液的质量时,将40 g合金的质量都加在了溶液中,没有注意到合金中未溶解的部分不属于溶液的成分。
