在20mL溶质质量分数为1.60%的某硫酸铜溶液中,逐滴加入某浓度的氢氧化钡溶液(发生的反应类似于硫酸铜利氢氧化钠的反应),用电导仪测得溶液的电导率(电导率越高表示溶液的导电性越好)、溶液的pH值随滴入Ba(OH)2溶液体积的变化曲线如下图所示(假设所有稀溶液的密度均为l g/cm3)
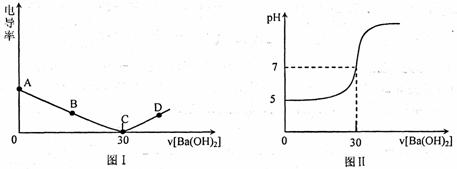
(1)硫酸铜和氢氧化钡溶液发生反应的化学方程式为: ▲ :
(2)图I中C点所示溶液中,含量较多的微粒有: ▲ ,D点所示溶液能导电是因为溶液中含有  ▲ ;
▲ ;
(3)将打磨过的铝片放入上述该硫酸铜溶液中,可以观察到的现象是: ▲ ;
(4)列式计算氢氧化钡溶液的溶质质量分数。
▲
(1)CuSO4 + Ba(OH)2 = BaSO4↓+ Cu(OH)2↓(1分)
(2)H2O(1分)
较多的自由移动的Ba2+、OH-(各1分,共2分,多写倒扣,0分为止)
(3)铝片表面有气泡,且表面有红色固体析出(各1分,2分,铝片溶解视而不见,多写错1个倒扣1分,0分为止。)
(4)解:20mL1.60%的硫酸铜溶液中CuSO4的质量为20mL×1g/cm3×1.60%=0.32 g(1分)
设与32 g硫酸铜完全反应需Ba(OH)2的质量为x
CuSO4 + Ba(OH)2 = BaSO4↓+ Cu(OH)2
160 171
0.32 g x
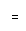 160 171
160 171

 0.32 g x
0.32 g x
x=0.342 g(1分)
0.342 g
 氢氧化钡溶液
氢氧化钡溶液 的溶质质量分数为:×100%= 1.14%(1分)
的溶质质量分数为:×100%= 1.14%(1分)
30 mL×1g/cm3
答:Ba(OH)2溶液的溶质质量分数为1.14%

![]() ▲ ;
▲ ;