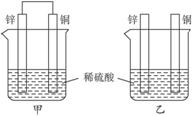
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速度甲比乙慢
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )

A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速度甲比乙慢
C
本题主要考查了原电池形成的条件和形成原电池的作用。
甲中铜、锌两种活动性不同的金属作电极,稀硫酸作电解质溶液,导线构成闭合回路形成原电池。活泼金属作负极,失电子被腐蚀损耗,不活泼金属作正极。
两极反应:正极(铜):2H++2e-====H2↑
负极(锌):Zn-2e-====Zn2+
所以A错。
形成原电池可以加快反应速率,所以D错。
乙中缺少导线,不能形成闭合回路构成原电池,发生的仅是活泼金属直接与稀硫酸的反应(Zn+2H+====Zn2++H2↑),不活泼金属铜不与稀硫酸反应。所以B错;C正确。