.参考下列图表和有关要求回答问题:
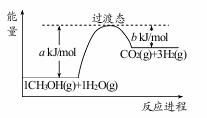
(1)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的一种原理是CH3OH(g)和H2O(g)反应生成CO2和H2。右图是该过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,正反应活化能 a的变化是_____ (填“增大”、“减小”、“不变”),反应热△H的变化是_____(填“增大”、“减小”、“不变”)。请写反应进程出CH3OH(g)和H2O(g)反应的热化学方程式_____。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的另一种反应原 理是:
理是:
CH3OH(g)+1/2O2(g) CO2(g)+2H2(g) △H=c kJ/mol
CO2(g)+2H2(g) △H=c kJ/mol
又知H2O(g) H2O(l) △H=d kJ/mol。
H2O(l) △H=d kJ/mol。
则甲醇燃烧生成液态水的热化学方程式为_____。
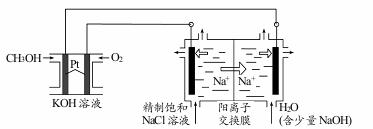
(3)以CH3OH燃料电池为电源电解法制取ClO2。二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
①CH3OH燃料电池放电过程中,通入O2的电极附近溶液的pH=_____,负极反应式为_____。
②图中电解池用石墨作电极,在一定条件下电解饱和食盐水制取 ClO2。阳极产生 ClO2的反应式为_____。
③电解一段时间,从阴极处收集到的气体比阳极处收集到气体多 6.72L时(标准状况,忽略生成的气体溶解),停止电解,通过阳离子交换膜的阳离子为_____mol。
(1)减小;不变;CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H=+(a-b)kJ/mol
(2)2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) △H=-(4a-4b-6c-4d)kJ/mol
(3)①增大 CH3OH-6e-+8OH-=CO32-+6H2O ②Cl--5e-+2H2O=4H++ClO2↑ ③1
【解析】
试题分析:(1)催化剂降低反应的活化能,加快反应速率,即a减小,但催化剂不能改变活化能,即反应热△H不变。根据图像可知反应热=akJ/mol-bkJ/mol,所以CH3OH(g)和H2O(g)反应的热化学方程式为CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H=+(a-b)kJ/mol。
(2)已知:①CH3OH(g)+1/2O2(g) CO2(g)+2H2(g) △H=c kJ/mol,②H2O(g)
CO2(g)+2H2(g) △H=c kJ/mol,②H2O(g) H2O(l) △H=d kJ/mol,③CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H=+(a-b)kJ/mol,则根据盖斯定律可知①×6+②×4-③×4即可得到甲醇燃烧生成液态水的热化学方程式为2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) △H=-(4a-4b-6c-4d)kJ/mol。
H2O(l) △H=d kJ/mol,③CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H=+(a-b)kJ/mol,则根据盖斯定律可知①×6+②×4-③×4即可得到甲醇燃烧生成液态水的热化学方程式为2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) △H=-(4a-4b-6c-4d)kJ/mol。
(3)以CH3OH燃料电池为电源电解法制取ClO2。二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
①CH3OH燃料电池放电过程中,通入O2的电极是正极,氧气得到电子转化为氢氧根,则附近溶液的pH增大,负极甲醇失去电子,反应式为CH3OH-6e-+8OH-=CO32-+6H2O。
②电解池中阳极失去电子,则阳极氯离子放电,产生ClO2的反应式为Cl--5e-+2H2O=4H++ClO2↑。
③电解一段时间,从阴极处收集到的气体比阳极处收集到气体多 6.72L时(标准状况,忽略生成的气体溶解),多出的气体是氢气,物质的量是0.3mol。设阳极产生的气体是xmol,
则根据电子得失守恒可知 5x=(0.3+x)×2,解得x=0.2,即转移1mol电子,钠离子通过阳离子交换膜,所以通过阳离子交换膜的阳离子为1mol。
5x=(0.3+x)×2,解得x=0.2,即转移1mol电子,钠离子通过阳离子交换膜,所以通过阳离子交换膜的阳离子为1mol。
【考点定位】本题主要是考查催化剂对反应速率、反应热的影响、盖斯定律应用及电化学原理的应用
【名师点晴】应对电化学定量计算的三种方法
(1)计算类型:原电池和电解池的计算包括两极产物的定量计算、溶液pH的计算、相对原子质量和阿伏加德罗常数的计算、产物的量与电量关系的计算等。
(2)方法技巧:
①根据电子守恒计算:用于串联电路中阴阳两极产物、正负两极产物、相同电量等类型的计算,其依据是电路中转移的电子数相等。
②根据总反应式计算:先写出电极反应式,再写出总反应式,最后根据总反应式列出比例式计算。
③根据关系式计算:根据得失电子守恒定律关系建立起已知量与未知量之间的桥梁,构建计算所需的关系式。例如: , (式中M为金属,n为其离子的化合价数值)该关系式具有总揽电化学计算的作用和价值,熟记电极反应式,灵活运用关系式便能快速解答常见的电化学计算问题。在电化学计算中,还常利用Q=I·t和Q=n(e-)×NA×1.60×10-19C来计算电路中通过的电量。
, (式中M为金属,n为其离子的化合价数值)该关系式具有总揽电化学计算的作用和价值,熟记电极反应式,灵活运用关系式便能快速解答常见的电化学计算问题。在电化学计算中,还常利用Q=I·t和Q=n(e-)×NA×1.60×10-19C来计算电路中通过的电量。


![]() 理是:
理是:![]() CO2(g)+2H2(g) △H=c kJ/mol
CO2(g)+2H2(g) △H=c kJ/mol![]() H2O(l) △H=d kJ/mol。
H2O(l) △H=d kJ/mol。
