KCl和KNO3的溶解度表及溶解度曲线如图所示,下列说法不正确的是 ( )
| 温度/℃ | 20 | 30 | 40 | 50 |
| 溶解度S/g | KCl | 34.0 | 37.0 | 40.0 | 42.6 |
| KNO3 | 31.6 | 45.8 | 63.9 | 85.5 |
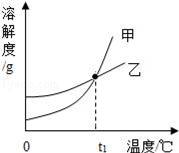

A.甲表示KCl溶解度曲线
B.温度t1应在20℃~30℃之间
C.40℃时,5gKCl加入10g水中,可得到33.3%的溶液
D.50℃时,30g KNO3加入50g水,充分溶解,再降温到30℃,有晶体析出
【考点】固体溶解度曲线及其作用;晶体和结晶的概念与现象;溶质的质量分数.
【分析】溶解度曲线能定量表示溶解度随温度的变化情况,根据固体物质的溶解度曲线可以:①溶解度曲线的交点表示该温度下两物质的溶解度相等;②判断物质的溶解度随温度变化的变化情况;③可知某温度下物质的溶解度;④溶质的质量分数=
 ×100%,据此解答.
×100%,据此解答.
【解答】解:A、硝酸钾的溶解度受温度影响变化大,故甲表示KO3溶解度曲线,错误;
B、t1时二者的溶解度相等,根据表格看出,该温度应该介于20℃~30℃之间,正确;
C、40℃时氯化钾的溶解度是40.0g,即100g水中最多溶解40.0g的氯化钾,所以5gKCl加入10g水中最多溶解4g,溶质的质量分数是: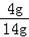
 ×100%≈28.6%,故错误;
×100%≈28.6%,故错误;
D、50℃时硝酸钾的溶解度是85.5g,所以30g KNO3加入50g水,充分溶解不饱和,再降温到30℃,其溶解度变为45.8g,50g水中最多溶解22.9g,所以有晶体析出,正确;
故选:AC.


