已知可逆反应:M(g)+N(g)⇌P(g)+Q(g),△H>0请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(M)=1mol•L﹣1,c(N)=2.4mol•L﹣1,达到平衡后,M的转化率为60%,此时N的转化率为 ;
(2)若反应在相同条件下进行达到平衡后,再向容器中充入M气体,再次达到平衡时该反应的平衡常数K (填“增大”“减小”或“不变”下同).
(3)若反应温度不变,反应物的起始浓度分别为:c(M)=4mol•L﹣1,c(N)=a mol•L﹣1,达到平衡后,c(P)=2mol•L﹣1,则a= .
【考点】CP:化学平衡的计算.
【分析】(1)达到平衡后,M的转化率为60%,反应浓度=1mol•L﹣1×60%=0.6mol;
M(g)+N(g)⇌P(g)+Q(g)
起始量(mol/L) 1 2.4 0 0
变化量(mol/L) 0.6 0.6 0.6 0.6
平衡量(mol/L)0.4 1.8 0.6 0.6,以此可计算N的转化率;
(2)平衡常数只受温度的影响;
(3)反应物的起始浓度分别为:c(M)=4mol•L﹣1,c(N)=a mol•L﹣1,达到平衡后,c(P)=2 mol•L﹣1,则:
M(g)+N(g)⇌P(g)+Q(g)
起始量(mol/L):4 a 0 0
转化量(mol/L):2 2 2 2
平衡量(mol/L):2 a﹣2 2 2
若反应温度不变,则平衡常数不变,再根据平衡常数列方程计算解答.
【解答】解:(1)达到平衡后,M的转化率为60%,反应浓度=1mol•L﹣1×60%=0.6mol;
M(g)+N(g)⇌P(g)+Q(g)
起始量(mol/L) 1 2.4 0 0
变化量(mol/L) 0.6 0.6 0.6 0.6
平衡量(mol/L)0.4 1.8 0.6 0.6,
转化率=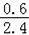
 ×100%=25%,
×100%=25%,
故答案为:25%;
(2)温度不变,则平衡常数不变,故答案为:不变;
(3)反应物的起始浓度分别为:c(M)=4mol•L﹣1,c(N)=a mol•L﹣1,达到平衡后,c(P)=2 mol•L﹣1,则:
M(g)+N(g)⇌P(g)+Q(g)
起始量(mol/L):4 a 0 0
转化量(mol/L):2 2 2 2
平衡量(mol/L):2 a﹣2 2 2
若反应温度不变,则平衡常数不变,则
 =
=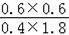
 ,解得a=6,
,解得a=6,
故答案为:6.
