下列关于晶体说法的正确组合是( )
①分子晶体中都存在共价键
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低
④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键
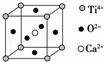
⑤CaTiO3晶体中(晶胞结构如图所示)每个Ti4+和12个O2﹣紧邻
⑥60gSi02中含Si﹣O键的个数为2NA
⑦晶体中分子间作用力越大,分子越稳定
⑧氯化钠熔化时离子键被破坏
⑨124g P4含有P﹣P键的个数为4NA.
| | A. | ①②③⑥ | B. | ①②④ | C. | ③⑤⑦ | D. | ③⑤⑧ |
考点:
晶胞的计算;化学键. | | 专题: | 化学键与晶体结构. |
| 分析: | ①分子晶体中不一定都存在共价键,单原子分子不存在共价键. ②在晶体中有阳离子不一定有阴离子. ③根据晶体类型判断熔点高低. ④离子晶体中一定含有离子键,可能含有共价键. ⑤采用沿X、Y、Z三轴切割的方法判断其配位数. ⑥每个硅原子存在4个Si﹣O键,根据二氧化硅质量计算硅原子个数,从而计算硅氧键个数. ⑦分子晶体中分子间作用力越大,分子越稳定 ⑧氯化钠熔化时离子键被破坏. ⑨每个白磷分子中含有6个共价键,根据白磷的分子个数计算白磷中含有的P﹣P共价键个数. |
| 解答: | 解:①分子晶体中不一定都存在共价键,如:稀有气体是单原子分子,在分子内不存在共价键,故错误. ②在晶体中有阳离子不一定有阴离子,如:金属晶体中存在的微粒是金属阳离子和自由电子,故错误. ③晶体中熔点高低一般顺序是:原子晶体>离子晶体>分子晶体;在原子晶体中,原子半径越大熔点越低;在离子晶体中,离子半径越大,熔点越低,电荷越多,熔点越高;在分子晶体中,物质的熔点与相对分子质量成正比(含有氢键的物质除外),所以这几种物质的熔点高低顺序是:金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低,故正确. ④离子晶体中一定含有离子键,可能含有共价键,分子晶体中肯定没有离子键,故错误. ⑤采用沿X、Y、Z三轴切割的方法知,CaTiO3晶体中(晶胞结构如图所示)每个Ti4+和12个O2﹣紧邻,故正确. ⑥一个硅原子含有4个硅氧键,60gSi02的物质的量1mol,所以含Si﹣O键的个数为4NA,故错误. ⑦分子晶体中分子间作用力越大,分子越稳定,在离子晶体、金属晶体和原子晶体中不存在分子间作用力,故错误. ⑧氯化钠熔化时离子键被破坏生成自由移动的阴阳离子,故正确. ⑨一个白磷分子中含有6个P﹣P键,124g P4的物质的量是1mol,所以含有P﹣P键的个数为6NA,故错误. 故选D. |
| 点评: | 本题考查的知识点较多,明确离子晶体中确定离子配位数的方法是:采用沿X、Y、Z三轴切割的方法;知道白磷分子是正四面体构型. |

