某合金由铝、铁、铜三种金属组成.现要测定一定质量该合金中铝的质量.设计以下流程并实验.
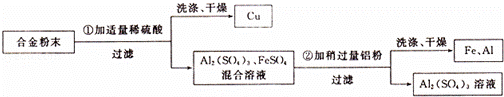
(1)通过以上实验也可验证三种金属的活动性顺序,写出判断依据.
(2)为什么要向合金粉末中加人适量的稀硫酸?
(3)为达到实验目的,需要称量上述流程中哪些物质的质量?如何确定铝的质量?
某合金由铝、铁、铜三种金属组成.现要测定一定质量该合金中铝的质量.设计以下流程并实验.

(1)通过以上实验也可验证三种金属的活动性顺序,写出判断依据.
(2)为什么要向合金粉末中加人适量的稀硫酸?
(3)为达到实验目的,需要称量上述流程中哪些物质的质量?如何确定铝的质量?
考点:
金属的化学性质..
专题:
金属与金属材料.
分析:
根据金属能与酸反应的排在氢前面,不能与酸反应的排在氢的后面,活泼的金属能把不活泼的金属从盐溶液中置换出来分析金属活动性的顺序及反应过程中发生的反应及试剂的作用并利用化学方程式进行计算.
解答:
解:(1)根据金属的活泼性顺序:铝>铁>氢>铜,所以向三种金属混合物中加入稀硫酸,铝、铁能够反应产生硫酸铝和硫酸亚铁,而铜不反应,得到的滤液再加入过量的铝,铝和硫酸亚铁反应产生硫酸铝和铁,因此说明铁的活动性比铁强,且位于氢前,而铜位于氢后,因此可以验证三种金属的活动性顺序;
(2)加入适量的稀硫酸可以把铝和铁都溶解;
(3)要测定混合物中铝的质量,需要知道混合物的质![]() 量、分离出铜和铁的质量,剩下的为铝,因此需要测量的量有:称量步骤①中的铜的质量、步骤②中加入铝粉的质量(假设为a),和铁铝混合物的质量(假设为b);铁的质量可以通过铝和硫酸亚铁的反应关系利用参加反应的铝的质量与铁的关系进行计算.
量、分离出铜和铁的质量,剩下的为铝,因此需要测量的量有:称量步骤①中的铜的质量、步骤②中加入铝粉的质量(假设为a),和铁铝混合物的质量(假设为b);铁的质量可以通过铝和硫酸亚铁的反应关系利用参加反应的铝的质量与铁的关系进行计算.
故答案为:(1)铝和铁都能和硫酸反应,铜不能和硫酸反应,说明铝和铁都位于氢前,铜位于氢后;铝能够和硫酸亚铁反应,说明铝比铁活泼,因此说明三种金属的活动性顺序为:铝>铁>铜;
(2)加入适量的稀硫酸可将合金中的铝、铁恰好溶解,既能测量出铜的质量,还能保证步骤②中所加的铝只能与硫酸亚铁反应,继而确定铁的质量;
(3)称量步骤①中的铜的质量、步骤②中加入铝粉的质量(假设为a),和铁铝混合物的质量(假设为b);根据铝与硫酸亚铁反应的化学方程式,求出铁的质量(设铁为x,剩余的铝为b﹣x,参加反应的铝质量为a﹣(b﹣x),利用二者的比例关系计算,此处过程可不写)因混合物质量已知,铜和铁已测出,则铝的质量可知.
点评:
本题以实验设计流程的形式让学生去利用金属活动性顺序表解决有关金属化学性质的问题,有一定的难度,解题的关键是熟练运用金属活动性的顺序意义.