硫铁矿又称黄铁矿,是生产硫酸的原料,其主要成分为FeS2.850℃~950℃时,硫铁矿在空气中煅烧,可能发生下列反应(设空气中N2与O2体积比为4:1):
3FeS2+8O2=Fe3O4+6SO2 ①
4FeS2+11O2=2Fe2O3+8SO2 ②
(1)含硫35%的硫铁矿样品(杂质不含硫),其FeS2的含量为 .
(2)设1t纯净的FeS2按②式完全反应,产生标准状况下SO2 m3.
(3)为使FeS2煅烧完全生成Fe2O3,工业上使用过量空气,当空气过量20%时,所得炉气中SO2的体积分数为多少? .
(4)480g纯净的FeS2在空气中完全反应,若所得固体中,Fe和O的物质的量之比n(Fe):n(O)=4:a,
此时消耗空气为bmol.
①试写出b与a的关系式:.
②并作出b与a的关系曲线.

【考点】化学方程式的有关计算;含硫物质的性质及综合应用.
【专题】计算题.
【分析】(1)FeS2的质量分数×FeS2中S元素质量分数=硫铁矿样品中S元素质量分数;
(2)根据方程式计算生成二氧化硫的体积;
(3)假设FeS2为4mol,为使FeS2煅烧完全生成Fe2O3,发生反应4FeS2+11O2=2Fe2O3+8SO2,利用方程式计算参加反应氧气、生成的二氧化硫以及气体物质的量减少的物质的量,进而计算通入的空气、反应后混合气体总物质的量,进而计算二氧化硫体积分数;
(4)①计算480g纯净的FeS2的物质的量,根据反应前后原子守恒计算;
②当生成Fe3O4,a值最小,为5.3mol,b=53.3,当生成氧化铁,a值最大,为6mol,b=55,描点做出图象.
【解答】解:(1)FeS2的质量分数×FeS2中S元素质量分数=硫铁矿样品中S元素质量分数,故FeS2的质量分数=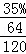 =65.6%,故答案为:65.6%;
=65.6%,故答案为:65.6%;
(2)4FeS2+11O2=2Fe2O3+8SO2
4×120 8×22.4L
1×106g V
V=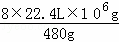 =3.733×105L=373.3m3,
=3.733×105L=373.3m3,
故答案为:373.3;
(3)假设FeS2为4mol,则:
4FeS2+11O2=2Fe2O3+8SO2 气体物质的量减少
4 11 8 3
4mol 11mol 8mol 3mol
氧气过量20%,则通入氧气为11mol×(1+20%)=13.2,空气的物质的量为: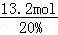 =66mol,故反应后混合气体总物质的量=66mol﹣3mol=63mol,
=66mol,故反应后混合气体总物质的量=66mol﹣3mol=63mol,
故所得炉气中SO2的体积分数=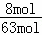 ×100%=12.7%,
×100%=12.7%,
答:所得炉气中SO2的体积分数为12.7%.
(4)①480g纯净的FeS2的物质的量为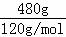 =4mol,则n(Fe)=4mol,n(S)=8mol,
=4mol,则n(Fe)=4mol,n(S)=8mol,
得到固体中n(Fe):n(O)=4:a,则固体中n(O)=a,
反应后生成n(SO2)=8mol,消耗空气为bmol,则n(O2)= bmol,
bmol,
根据反应前后氧原子守恒: b×2=a+8×2,则b=2.5a+40,
b×2=a+8×2,则b=2.5a+40,
故答案为:b=2.5a+40.
②当生成Fe3O4,a值最小,为5.3mol,b=53.3,当生成氧化铁,a值最大,为6mol,b=55,描点做出图象为: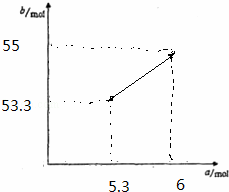 故答案为:
故答案为: .
.
【点评】本题考查化学计算,涉及根据方程式计算、守恒计算等,题目属于拼合型,题量大、计算量较大,过程比较复杂,综合考查学生分析解决问题的能力,对学生的心理素质有较高的要求,难度中等.


 故答案为:
故答案为: .
.