已知某工业废水中含有大量FeSO4较多的CuSO4少量的Na2SO4以及部分污泥
已知某工业废水中含有大量FeSO4较多的CuSO4少量的Na2SO4以及部分污泥,通过下列流程可从该废水中回收FeSO4·7H2O晶体及金属Cu。
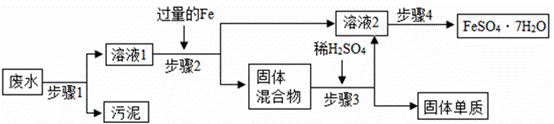
(1)步骤1、步骤2、步骤3的主要操作是相同的,需用到的玻璃仪器除烧杯和玻璃棒外还有_____。
(2)步骤2中发生反应的化学方程式为_____。
(3)步骤3中发生反应的化学方程式为_____。
(4)步骤4中涉及的操作是:蒸发浓缩、降温结晶、过滤、洗涤、烘干,过滤后滤液中还存在的金属阳离子有_____。
(5)最后的固体单质是_____(填名称)
(6)若测得某溶液中仅有钠离子、镁离子、硫酸根离子、氯离子这四种离子,已知钠离子、镁离子、氯离子个数之比为4:5:8,若钠离子为4n个,则硫酸根离子的个数是_____。
(1)漏斗 (2)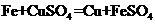 (3)
(3)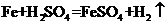 (4)Na+、Fe2+ (5)铜 (6)3n
(4)Na+、Fe2+ (5)铜 (6)3n
【解析】(1)步骤1、步骤2、步骤3的主要操作是过滤,过滤需要用到的玻璃仪器有烧杯、玻璃棒、漏斗;(2)步骤2中加入过量的铁主要是把废水中的硫酸铜反应完,也就是铁与硫酸铜反应生成铜和硫酸亚铁,反应的化学方程式是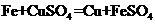 ;(3)步骤3中加入稀硫酸是与步骤2中过量的铁反应生成硫酸亚铁和氢气,反应的化学方程式是
;(3)步骤3中加入稀硫酸是与步骤2中过量的铁反应生成硫酸亚铁和氢气,反应的化学方程式是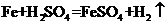 ;(4)步骤4中涉及的操作是:蒸发浓缩、降温结晶、过滤、洗涤、烘干,过滤后滤液中的溶质是硫酸亚铁和硫酸钠的混合物,溶液中的金属阳离子是Na+、Fe2+;(5)步骤2中得到的固体是铜、铁,步骤3中加入稀硫酸,铁与稀硫酸反应,铜不会与稀硫酸反应,最后的固体单质是铜;(6)1个钠离子带1个单位的正电荷、1个镁离子带2个单位的正电荷、1个硫酸根离子带2个单位的负电荷、1个氯离子带1个单位的负电荷,已知钠离子、镁离子、氯离子个数之比为4:5:8,钠离子为4n个,则镁离子为5n个、氯离子为8n个;设硫酸根离子的个数为x,根据溶液中电荷守恒(即正电荷总数=负电荷总数)得:4n× (+1)+5n×(+2)= 8n×1+2x , x=3n
;(4)步骤4中涉及的操作是:蒸发浓缩、降温结晶、过滤、洗涤、烘干,过滤后滤液中的溶质是硫酸亚铁和硫酸钠的混合物,溶液中的金属阳离子是Na+、Fe2+;(5)步骤2中得到的固体是铜、铁,步骤3中加入稀硫酸,铁与稀硫酸反应,铜不会与稀硫酸反应,最后的固体单质是铜;(6)1个钠离子带1个单位的正电荷、1个镁离子带2个单位的正电荷、1个硫酸根离子带2个单位的负电荷、1个氯离子带1个单位的负电荷,已知钠离子、镁离子、氯离子个数之比为4:5:8,钠离子为4n个,则镁离子为5n个、氯离子为8n个;设硫酸根离子的个数为x,根据溶液中电荷守恒(即正电荷总数=负电荷总数)得:4n× (+1)+5n×(+2)= 8n×1+2x , x=3n

