工业上生产硫酸时,利用催化氧化反应将SO2 转化为SO3是一个关
工业上生产硫酸时,利用催化氧化反应将SO2 转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为: SO2 7% ,O2 11%,N2 82%):
SO2 7% ,O2 11%,N2 82%):
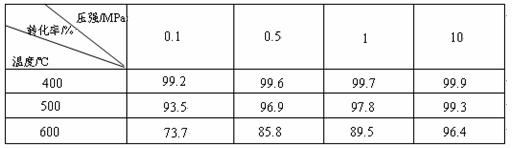
(1)已知SO2的氧化是放热反应,如何利用表中数据推断此结论?
;
(2)在大400~500℃时,SO2的催化氧化采用常压而不是高压,主要原因是:
;
(3)选择适宜的催化剂,是否可以提高SO2的转化率? (填“是”或“否”),是否可以增大该反应所放出的热量? (填“是”或“否”);
(4)为提高SO3吸收率,实际生产中用 吸收SO3;
(5)已知:2SO2(g)+O2(g)=2SO3(g);△H=-196.6kJ·mol-1,计算每生产1万吨98%硫酸所需要的SO3质量和由SO2生产这些SO3所放出的热量。
【答案】
(1)压强一定时,温度升高时,SO2转化率下降,说明升温有利于逆反应进行,所以正反应为放热反应;
(2)增大压强对提高SO2转化率无显著影响,反而会增加成本;
(3)否 否
(4)浓硫酸
(5)解:1万吨98%的硫酸含H2SO4的质量:9.8×109g
设需要SO3的质量为x,该反应产生的热量为y。
H2SO4 — SO3 — △H
98g 80g -196.6×0.5KJ
9.8×109g x y
x=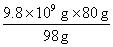 =8.0×10×9g=8.0×103t
=8.0×10×9g=8.0×103t
y=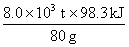 =9.83×109kJ
=9.83×109kJ
【解析】由表中的数据,在压强相同条件下升高温度,SO2的转化率降低,平衡向左移动,正反应为放热反应。当增大压强时SO2的转化率变化不大,且常压下转化率已较大。使用催化剂加快反应速率,平衡不移动,转化率不变,也不能增大反应放出热量,因为参加反应的量没变化。为了防止形成酸雾不利于SO3吸收,实际上用浓H2SO4来吸收SO3。由1万吨98%硫酸中H2SO4的量来计算SO3质量及放出热量。
![]() SO2 7% ,O2 11%,N2 82%):
SO2 7% ,O2 11%,N2 82%):
