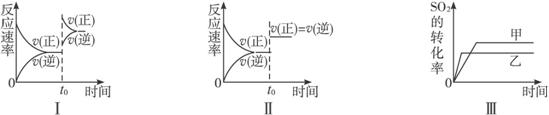
A.图Ⅰ研究的是t0时刻增大O2的物质的量浓度对反应速率的影响
B.图Ⅱ研究的是t0时刻通入氦气增大体系压强对反应速率的影响
C.图Ⅲ研究的是催化剂对化学平衡的影响,且甲的催化效率比乙高
D.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高

A.图Ⅰ研究的是t0时刻增大O2的物质的量浓度对反应速率的影响
B.图Ⅱ研究的是t0时刻通入氦气增大体系压强对反应速率的影响
C.图Ⅲ研究的是催化剂对化学平衡的影响,且甲的催化效率比乙高
D.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
D
解析:t0时刻增大O2的物质的量浓度后,v(正)增大,v(逆)开始不变,随后增大,故A不正确;t0时刻通入氮气增大体系压强,因体积不变,物质的浓度不变,所以速率不变,故B不正确;催化剂不使平衡发生移动,不影响SO2的转化率,故C不正确;因为正反应是放热反应,所以温度升高,平衡向逆反应方向移动,SO2的转化率降低,又因为温度升高,反应速率加快,所以温度高时先达到平衡,D正确。