热电厂用碱式硫酸铝吸收烟气中低浓度的二氧化硫.具体过程如下:
(1)碱式硫酸铝溶液的制备
往Al2(SO4)3溶液中加入一定量CaO粉末和蒸馏水,可生成碱式硫酸铝(络合物,易溶于水),同时析出生石膏沉淀,反应的化学方程式为 .
(2)SO2的吸收与解吸.吸收液中碱式硫酸铝活性组分Al2O3对SO2具有强大亲和力,化学反应为:Al2(SO4)3•Al2O3(aq)+3SO2(g)⇌Al2(SO4)3•Al2(SO3)3(aq)△H<0.工业流程如图1所示:
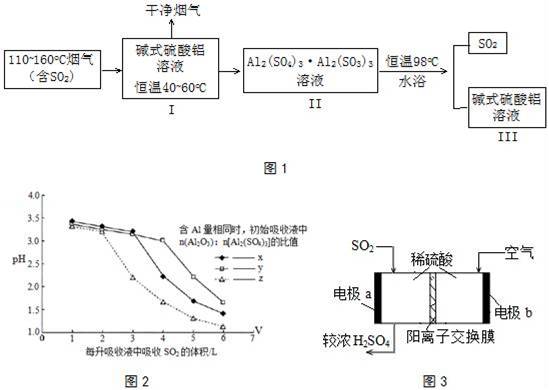

①高温烟气可使脱硫液温度升高,不利于SO2的吸收.生产中常控制脱硫液在恒温40~60oC,试分析原因 .
②研究发现,I中含碱式硫酸铝的溶液与SO2结合的方式有2种:其一是与溶液中的水结合.其二是与碱式硫酸铝中的活性Al2O3结合,通过酸度计测定不同参数的吸收液的pH变化,结果如2图所示:
据此判断初始阶段,SO2的结合方式是 .比较x、y、z的大小顺序 .
③III中得到再生的碱式硫酸铝溶液,其n(Al2O3):n比值相对I中有所下降,请用化学方程式加以解释: .
(3)解吸得到较纯的SO2,可用于原电池法生产硫酸如图3.
①电极b周围溶液pH (填“变大”、“变小”或“不变”)
②电极a的电极反应式是 .
【考点】U3:制备实验方案的设计.
【分析】(1)往Al2(SO4)3溶液中加入一定量CaO粉末和蒸馏水,可生成碱式硫酸铝Al2(SO4)3•Al2O3,同时析出生石膏沉淀,根据质量守恒配平即可;
(2)碱式硫酸铝溶液与含有二氧化硫的烟气在在恒温40~60oC反应Al2(SO4)3•Al2O3(aq)+3SO2(g)⇌Al2(SO4)3•Al2(SO3)3(aq)△H<0,得到Al2(SO4)3•Al2(SO3)3溶液,对该溶液恒温98℃,溶液分解得到二氧化硫和碱式硫酸铝溶液,
①根据反应的热效应分析可得;
②由图2可知,碱式硫酸铝中的活性Al2O3含量不同时,酸度计测定不同参数的吸收液的pH有变化,说明SO2的结合方式是与活性Al2O3结合,pH相同时,活性Al2O3吸收越多SO2,则y>x>z;
③Al2(SO4)3•Al2(SO3)3溶液恒温98℃,溶液分解得到III中得到再生的碱式硫酸铝溶液,分解过程中部分Al2(SO3)3被氧化为Al2(SO4)3,其n(Al2O3):n比值相对I中有所下降;
(3)①电极b为空气中氧气放电结合氢离子的反应,氢离子浓度减小,pH增大;
②电极a为二氧化硫放电失电子发生的氧化反应.
【解答】解:(1)往Al2(SO4)3溶液中加入一定量CaO粉末和蒸馏水,可生成碱式硫酸铝Al2(SO4)3•Al2O3,同时析出生石膏沉淀,化学方程式为:2Al2(SO4)3+3CaO+6H2O=Al2(SO4)3•Al2O3+3CaSO4•2H2O;
故答案为:2Al2(SO4)3+3CaO+6H2O=Al2(SO4)3•Al2O3+3CaSO4•2H2O;
(2)①碱式硫酸铝吸收SO2的反应为放热反应,降温使平衡正向移动,有利于SO2的吸收,生产中常控制脱硫液在恒温40~60oC;
故答案为:碱式硫酸铝吸收SO2的反应为放热反应,降温使平衡正向移动,有利于SO2的吸收;
②由图2可知,碱式硫酸铝中的活性Al2O3含量不同时,酸度计测定不同参数的吸收液的pH有变化,说明SO2的结合方式是与活性Al2O3结合,pH相同时,活性Al2O3吸收越多SO2,则y>x>z;
故答案为:与活性Al2O3结合;y>x>z;
③Al2(SO4)3•Al2(SO3)3溶液恒温98℃,溶液分解得到III中得到再生的碱式硫酸铝溶液,分解过程中部分Al2(SO3)3被氧化为Al2(SO4)3,2Al2(SO3)3+3O2=2Al2(SO4)3或2+3O2=4Al2(SO4)3,其n(Al2O3):n比值相对I中有所下降;
故答案为:2Al2(SO3)3+3O2=2Al2(SO4)3或2+3O2=4Al2(SO4)3;
(3)①电极b为空气中氧气放电结合氢离子的反应,氢离子浓度减小,pH增大;
故答案为:变大;
②电极a为二氧化硫放电失电子发生的氧化反应,电极反应式为:SO2﹣2e﹣+2H2O=4H++SO42﹣;
故答案为:SO2﹣2e﹣+2H2O=4H++SO42﹣.


