常温下,A、B、C、M都是气体,A、B、D、M是常见的单质,A的式量比B
常温下,A、B、C、M都是气体,A、B、D、M是常见的单质,A的式量比B大,C在空气中呈现雾状,甲、乙、丙是常见的化合物,形成L单质的元素是地壳中含量最多的金属元素。它们之间的转化关系如下所示。由此可推知:

(1)形成L单质的元素在元素周期表的位置是__________,该元素的某种化合物常用于净水,其净水的原理用离子方程式可表示为_______________________。
(2)C的电子式是。其晶体的熔点和沸点要比化合物乙的熔点和沸点____________。(填“高”或“低”)
(3)实验室制取气体A的化学方程式是_____________________________________。
(4)写出L单质与氢氧化钠溶液反应的离子方程式_________________________。A与E反应的离子方程式。
(5)写出D与乙反应的化学方程式为_________________。L与甲的反应可以称为__________________。该反应能够发生的原因是____________________。
(1)第3周期,第ⅢA族 Al 3++3H2O Al(OH)3(胶体)+3H +
Al(OH)3(胶体)+3H +
(2)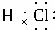 低
低
(3)MnO2+4HCl(浓)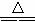 Cl2↑+MnCl2+2H2O
Cl2↑+MnCl2+2H2O
(4)2Al+2OH -+2H2O══2AlO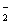 +3H2↑
+3H2↑
2Fe 2++Cl2══2Fe 3++2Cl -
(5)3Fe+4H2O(g)  Fe3O4+4H2 铝热反应 铝的还原性比铁的强,反应放出大量的热(其他正确答案也可)
Fe3O4+4H2 铝热反应 铝的还原性比铁的强,反应放出大量的热(其他正确答案也可)
解析:A、B为单质气体,二者形成气体C。C在空气中呈现雾状,C与单质D反应产生气体单质B,且式量A>B,故可推知A为Cl2,B为H2,C为HCl,D与HCl产生H2,产物E与Cl2反应得F,故D为Fe、E为FeCl2、F为FeCl3。L是地壳中含量最多的金属,故为Al。Fe和单质气体M生成甲。甲和Al反应,故甲为Fe3O4,丙为Al2O3,Fe与乙生成H2和Fe3O4,故乙为H2O。

