电解装置如图所示。图中B装置盛1 L 2 mol·L-1的Na2SO4溶液,A装置中盛
电解装置如图所示。图中B装置盛1 L 2 mol·L-1的Na2SO4溶液,A装置中盛1 L 2
mol·L-1 AgNO3溶液。通电后,湿润的淀粉KI试纸的C端变蓝色。电解一段时间后,试回
答:
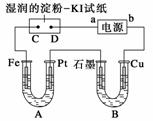
(1)A中发生反应的化学方程式为_________________________________________。
(2)在B中观察到的现象是_____________________________________________。
(3)室温下若从电解开始到时间t时,A、B装置中共收集到0.168 L(标准状况)气体。若电
解过程中无其他副反应发生,且溶液体积变化忽略不计,则在t时,A溶液中酸的浓度为________。
答案 (1)4AgNO3+2H2O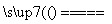 4Ag+O2↑+4HNO3
4Ag+O2↑+4HNO3
(2)接通电源后,铜棒周围开始变为蓝色,石墨棒上有无色气泡产生,一段时间后,U形管底部出现蓝色絮状沉淀 (3)0.01 mol·L-1
解析 (1)A池中Fe为阴极:4Ag++4e-—→4Ag;Pt为阳极:4OH-—→2H2O+O2↑+4e-,故反应的化学方程式为:4AgNO3+2H2O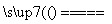 4Ag+O2↑+4HNO3。
4Ag+O2↑+4HNO3。
(2)B池中Cu为阳极:Cu—→Cu2++2e-,石墨为阴极:2H++2e-—→H2↑,阴极H+放电,破坏水的电离平衡,生成OH-,与阳极生成的Cu2+在U形管底部相遇生成沉淀:Cu2++2OH-===Cu(OH)2↓。
(3)4HNO3~4e-~O2↑~2H2↑
4 mol 22.4 L+22.4 L×2
n(HNO3) 0.168 L
n(HNO3)=0.01 mol
[HNO3]=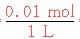 =0.01 mol·L-1。
=0.01 mol·L-1。

