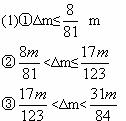将Na
2O
2和NaHCO
3固体混合物置于密闭容器中加热充分反应,放出气体后冷却。加热时可能发生的反应如下:
2Na2O2+2NaHCO3 2NaOH+2Na2CO3+O2↑
2NaOH+2Na2CO3+O2↑
2Na2O2+4NaHCO3 4Na2CO3+O2↑+2H2O
4Na2CO3+O2↑+2H2O
2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(1)若固体混合物的质量为m,反应后冷却再称其质量减少了Δm。设NaHCO3、Na2O2的物质的量分别为a、b,试确定下列条件下Δm的取值范围(用含m的代数式表示)。
①当a/b≤1时,Δm取值范围是_____________________。
②当1<a/b≤2时,Δm取值范围是___________________。
③当a/b>2时,Δm取值范围是______________________。
(2)若m=14.52 g,Δm= 1.28 g时,向反应后的残留固体内滴加2.00 mol·L-1盐酸140.0 mL,可产生标准状况下的气体____________ L。
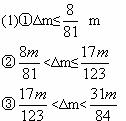
(2)2.016
解析:(1)①当a/b≤1时,反应按下式进行,Δm=m(O2)。则
2Na2O2+2NaHCO3 2NaOH+2Na2CO3+O2↑
2NaOH+2Na2CO3+O2↑
2×78+2×84 32
m Δm
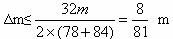
②当1<a/b≤2时,反应在上式基础上将按下式进行,Δm=m(O2)+m(H2O),则
2Na2O2+4NaHCO3 4Na2CO3+O2↑+2H2O
4Na2CO3+O2↑+2H2O
2×78 4×84 32+36
m Δm
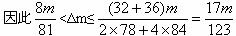
③当a/b>2时,同理可求得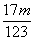
<Δm<
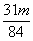
。
(2)因为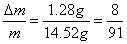
,属a/b<1的情况,Na
2O
2过量,则Δm=m(O
2),
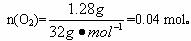
2Na2O2+2NaHCO3 2NaOH + 2Na2CO3+O2↑
2NaOH + 2Na2CO3+O2↑
0.08 mol 0.08 mol 0.08 mol 0.04 mol
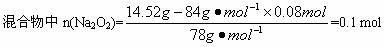
因此,残留固体内还有n(Na2O2)=0.1 mol-0.08 mol=0.02 mol,
n(NaOH)=0.08 mol,n(Na2CO3)=0.08 mol,滴加n(HCl)=2.00 mol·L-1×0.140 L=0.280 mol时,发生的反应有:
2Na2O2+2H2O====4NaOH+O2↑
0.02 mol 0.04 mol 0.01 mol
NaOH + HCl====NaCl+H2O
(0.04+0.08) mol 0.12 mol
Na2CO3+HCl====NaCl+NaHCO3
0.08 mol 0.08 mol 0.08 mol
NaHCO3+HCl====NaCl+H2O+CO2↑
0.08 mol 0.08 mol 0.08 mol
所以,可产生标准状况下的气体V=(0.08+0.01) mol×22.4 L·mol-1=2.016 L。
![]() 2NaOH+2Na2CO3+O2↑
2NaOH+2Na2CO3+O2↑![]() 4Na2CO3+O2↑+2H2O
4Na2CO3+O2↑+2H2O![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O