食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的.已知:氧化性:IO3﹣>Fe3+>I2;还原性:S2O32﹣>I﹣3I2+6OH﹣═IO3﹣+5I﹣+3H2O;
KI+I2 KI3
KI3
(1)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为3份.第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色.
①加KSCN溶液显红色,该红色物质是 (用化学式表示);CCl4中显紫红色的物质是 (用电子式表示).
②第二份试液中加入足量KI固体后,反应的离子方程式为 、 .
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失.写出潮湿环境下KI与氧气反应的化学方程式: .将I2溶于KI溶液,在低温条件下,可制得KI3•H2O.该物质作为食盐加碘剂是否合适? (填“是”或“否”),并说明理由 .
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失.下列物质中有可能作为稳定剂的是 .
A.Na2S2O3 B.AlCl3 C.Na2CO3 D.NaNO2
(4)对含Fe2+较多的食盐(假设不含Fe3+),可选用KI作为加碘剂.请设计实验方案,检验该加碘盐中的Fe2+. .
考点:
氧化还原反应;氧化性、还原性强弱的比较;二价Fe离子和三价Fe离子的检验.. | | 专题: | 氧化还原反应专题. |
| 分析: | (1)①给出的离子中,只有Fe3+遇KSCN溶液显红色,Fe3+与KI发生氧化还原反应生成的碘单质,易溶于有机溶剂,且碘在四氯化碳中显紫色; ②具有氧化性的离子为IO3﹣、Fe3+,具有还原性的离子为I﹣,利用氧化还原反应来分析; (2)根据KI具有还原性及氧化还原反应、KI3在常温下不稳定性来分析; (3)根据提高加碘盐(添加KI)的稳定性,主要是防止I﹣ 被氧化来分析; (4)将亚铁离子转化为铁离子,再利用铁离子遇KSCN溶液变红色来检验. |
| 解答: | 解:(1)某加碘盐可能含有KIO3、KI、Mg2+、Fe3+,用蒸馏水溶解,并加稀盐酸酸化后将溶液分为3份.从第一份试液中滴加KSCN溶液后显红色,可知该加碘盐中含有Fe3+,反应:Fe3++3SCN﹣=Fe(SCN)3,Fe(SCN)3呈血红色;从第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色,可知有碘生成.这是因为由于“氧化性:IO3﹣>Fe3+>I2”,加足量KI后,IO3﹣和Fe3+均能将I﹣氧化成I2,由此也可以知道该加碘盐添加KIO3;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色.由此可知该加碘盐中不含KI. ①该加碘盐溶液中加KSCN溶液显红色的物质是Fe(SCN)3,CCl4中显紫红色的物质是I2,电子式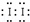 ,故答案为:Fe(SCN)3; ,故答案为:Fe(SCN)3;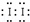 ; ; ②第二份试液中加入足量KI固体后,反应的离子方程式为IO3﹣+5I﹣+6H+═3I2+3H2O、2Fe3++2I﹣═2Fe2++I2,故答案为:IO3﹣+5I﹣+6H+═3I2+3H2O;2Fe3++2I﹣═2Fe2++I2; (2)KI作为加碘剂的食盐在保存过程中,KI会被空气中氧气氧化,KI在潮湿空气中氧化的反应化学方程式为:4KI+O2+2H2O═2I2+4KOH,根据题目告知,KI3•H2O是在低温条件下,由I2溶于KI溶液可制得.再由题给的信息:“KI+I2 KI3”,可知KI3在常温下不稳定性,受热(或潮湿)条件下易分解为KI和I2,KI又易被空气中的氧气氧化,I2易升华,所以KI3•H2O作为食盐加碘剂是不合适的,故答案为:4KI+O2+2H2O═2I2+4KOH;否;KI3受热(或潮湿)条件下产生KI和I2,KI被氧气氧化,I2易升华; KI3”,可知KI3在常温下不稳定性,受热(或潮湿)条件下易分解为KI和I2,KI又易被空气中的氧气氧化,I2易升华,所以KI3•H2O作为食盐加碘剂是不合适的,故答案为:4KI+O2+2H2O═2I2+4KOH;否;KI3受热(或潮湿)条件下产生KI和I2,KI被氧气氧化,I2易升华; (3)提高加碘盐(添加KI)的稳定性,主要是防止I﹣ 被氧化,根据题给信息“还原性:S2O32﹣>I﹣”和氧化还原反应的强弱规律,可以选Na2S2O3作稳定剂;又由题给信息 “3I2+6OH﹣═IO3﹣+5I﹣+3H2O”,可知I2与OH﹣会发生反应生成IO3﹣和5I﹣,而Na2CO3水解呈碱性,因而也可以用Na2CO3作稳定剂,防止加碘盐(添加KI)在潮湿环境下被氧气氧化.至于AlCl3,水解后呈酸性,且还原性I﹣>Cl﹣,所不能作稳定剂;NaNO2当遇强还原性物质时能表现出氧化性,则NaNO2与KI能发生氧化还原反应为 2NO2﹣+2I﹣+4H+=2NO↑+I2+2H2O,所以不能作稳定剂,故答案为:AC; (4)实际上就是设计实验方案,检验Fe2+.首先可取足量该加碘盐溶于蒸馏水中,然后用盐酸酸化后,滴加适量氧化剂(如:氯水、过氧化氢等),使溶液中Fe2+转化为Fe3+,再滴加KSCN溶液,若显血红色,则该加碘盐中存在Fe2+,故答案为:取足量该加碘盐溶于蒸馏水中,用盐酸酸化,滴加适量氧化剂(如:氯水、过氧化氢等),再滴加KSCN溶液,若显血红色,则该加碘盐中存在Fe2+. |
| 点评: | 本题以日常生活中熟悉的食盐和加碘盐中碘的损失原因为素材,要求通过实验,检验加碘盐中所含有的成分物质,探究保存过程中由于空气中氧气的作用容易引起碘损失的反应、探讨KI3•H2O作为食盐加碘剂是否合适、以及提高加碘盐(添加KI)的稳定性可添加的稳定剂,设计实验方案检验选用KI作为加碘剂的加碘盐中的Fe2+等,从而考查物质的检验、氧化还原反应和氧化还原反应方程式、离子反应和离子反应方程式、电子式、以及实验方案的设计等化学基础知识和基本技能.试题突了有效获取知识并与已有知识整合的能力,突出了能够从新信息中准确提取实质性的内容,并与所学的知识进行有效结合,解决实际问题的能力.体现了新课程《考试说明》(化学部分)对学习能力的要求. |
![]() KI3
KI3